Inmunocitoquímica
|
|
Este artículo no citar cualquier referencias o fuentes. (Septiembre de 2009) |
|
|
Este artículo necesita atención de un experto en Biología Molecular y celular. (Febrero de 2009) |
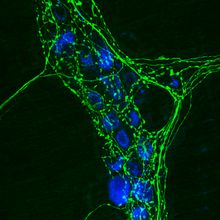
Inmunocitoquímica (CORTE PENAL INTERNACIONAL) es un común técnica de laboratorio que se utiliza para visualizar anatómicamente la localización de una proteína específica o antígeno en las células por medio de una específicos anticuerpo primario que se une a él. El anticuerpo primario permite la visualización de la proteína bajo un microscopio de fluorescencia Cuando se enlaza a un anticuerpo secundario que tiene un conjugado fluoróforo. ICC permite a los investigadores a evaluar si las células en una muestra particular expresa el antígeno en cuestión. En los casos donde un immunopositive señal es encontrado, ICC también permite a los investigadores a determinar que compartimientos del celulares expresan el antígeno.
Contenido
- 1 Inmunocitoquímica vs inmunohistoquímica
- 2 Métodos
- 3 Referencias
- 4 Enlaces externos
Inmunocitoquímica vs inmunohistoquímica
Immunocytochemistry difiere Immunohistochemistry en que el primero se realiza en muestras de las células intactas han tenido la mayoría, si no todo, de su entorno matriz extracelular quitar.[citación necesitada] Esto incluye las células cultivadas dentro de un cultura, de suspensión, o tomados de un borrón de transferencia. En contraste, las muestras de immunohistochemical son secciones de tejido biológico, donde cada celda está rodeado por arquitectura de tejido y otras células normalmente encontradas en el tejido intacto. Inmunocitoquímica es una técnica utilizada para evaluar la presencia de una proteína específica o antígeno en las células (células cultivadas, suspensiones celulares) por el uso de un anticuerpo específico, que se une a él, lo que permite la visualización y examen bajo un microscopio. Es una herramienta valiosa para la determinación del contenido celular de las células individuales. Muestras que pueden analizarse incluyen frotis de sangre, aspirados, hisopos, células cultivadas y suspensiones celulares.
Hay muchas formas de preparar muestras de células para análisis de immunocytochemical. Cada método tiene sus propias fortalezas y características únicas por lo que puede elegir el método adecuado para la muestra deseada y el resultado.
Células para teñirse pueden fijarse a un soporte sólido para permitir la fácil manipulación en procedimientos posteriores. Esto puede lograrse por varios métodos: las células adherentes pueden cultivarse sobre portaobjetos, cubreobjetos o en un soporte plástico ópticamente adecuado. Células de suspensión pueden centrifugadas sobre portaobjetos (cytospin), destinadas a soporte sólido usando a linkers químicos o en algunos casos manejadas en suspensión.
Concentrados suspensiones celulares que existen en un medio de baja viscosidad hacen buenos candidatos para frotis. Suspensiones celulares diluido en un medio diluido son los más adecuados para la preparación de cytospins mediante citocentrifugación. Suspensiones celulares que existen en un medio de alta viscosidad, son los más adecuados para ser probado como preparaciones de la torunda. La constante entre estas preparaciones es que la célula entera está presente en la superficie del portaobjetos. Para que cualquier reacción intercelular que tendrá lugar, inmunoglobulina primero debe atravesar la membrana celular que está intacta en estos preparativos. Las reacciones que tienen lugar en el núcleo pueden ser más difíciles, y los líquidos extracelulares pueden crear únicos obstáculos en el desempeño de inmunocitoquímica. En esta situación, hace necesario permeabilizing células con detergente (Triton X-100 o Tween 20) o elegir fijadores orgánicos (acetona, metanol o etanol).
Los anticuerpos son una herramienta importante para demostrar la presencia y la localización subcelular de un antígeno. Tinción celular es una técnica muy versátil y, si el antígeno es muy localizado, puede detectar tan poco como 1 mil moléculas de antígeno en una célula. En algunas circunstancias, la célula tinción puede usarse para determinar la concentración aproximada de un antígeno, especialmente por un analizador de imagen.
Métodos
Hay muchos métodos para obtener la detección inmunológica de los tejidos, los vinculados directamente a anticuerpos primarios o antisueros incluidos. Un método directo implica el uso de una etiqueta detectable (por ejemplo, la molécula fluorescente, partículas de oro, etc.) directamente al anticuerpo que luego se unen al antígeno (p. ej., proteína) en una celda.
Alternativomente, hay muchos métodos indirectos. Un tal método, el antígeno está limitado por un anticuerpo primario que luego es amplificado por el uso de un anticuerpo secundario que se une al anticuerpo primario. A continuación, un reactivo terciario que contiene una molécula enzimática se aplica y se une al anticuerpo secundario. Cuando el Cuaternario reactivo o sustrato, se aplica, enzimático final del terciario reactivo convierte el sustrato en un producto de la reacción del pigmento, que produce un color (muchos colores son posibles, marrón, negro, rojo, etc.,) en la misma ubicación que el anticuerpo primario original reconocieron que el antígeno de interés.
Algunos ejemplos de sustratos utilizado (también conocido como cromógenos) son (AEC (3-Amino-9-EthylCarbazole) o lenguado3, 3'-diaminobenzidina). Uso de uno de los reactivos después de la exposición a la enzima necesaria (por ejemplo, peroxidasa conjugada con un reactivo de anticuerpo) produce un producto immunoreaction positivo. Visualización inmunocitoquímica de los antígenos específicos de interés puede utilizarse cuando una mancha menos específica como H & E (hematoxilina y eosina) no puede utilizarse para un diagnóstico a realizarse o a proporcionar información predictiva adicional en relación con el tratamiento (en algunos tipos de cáncer, por ejemplo).
Alternativamente el anticuerpo secundario puede ser covalente a una fluoróforo (FITC y Rodamina son los más comunes) que se detecta en una fluorescencia o un microscopio confocal. La ubicación de fluorescencia variará según la molécula objetivo, para proteínas de membrana externa e interna para proteínas citoplasmáticas. De esta manera inmunofluorescencia es una técnica poderosa cuando se combina con microscopía confocal para el estudio de la localización dinámica de las proteínas y procesos)exocitosis, endocitosisetc..).
Referencias
Referencias:
- Protocolos y métodos de inmunocitoquímica. Editado por Lorette C. Javois, 2da edición, 1999. Prensa de humana.
- Etiquetado de inmunofluorescencia de células (Sigma-Aldrich)
- Protocolo de Stephen B. Howell Lab – inmunocitoquímica: https://cancer.UCSD.edu/howelllab/Immunocyto.html
- Protocolo de inmunotinción para células con Still videos demo (Lamond Lab, Universidad de Dundee). https://www.lamondlab.com/f7immunostainprotocol.htm
- Protocolo de laboratorio Spector – técnica de inmunofluorescencia. https://spectorlab.cshl.edu/immunofluorescence.html
- Inmunofluorescencia en células cultivadas (Universidad de Londres) https://www.KCl.AC.uk/depsta/Biomedical/Randall/Methods/im-fluo.html
- Procedimientos de fluorescencia para la actina y la tubulina citoesqueleto en células fijas https://mitchison.med.Harvard.edu/Protocols/GEN1.html
- El manual de sondas moleculares: Una guía para sondas fluorescentes y tecnologías de etiquetado (11ª Edición)-- https://www.Invitrogen.com/site/US/en/Home/Brands/molecular-probes.html
Enlaces externos
- Protocolo de tinción inmunocitoquímica
- Inmunohistoquímica de embriones de ratón de Whole-Mount
|
||||||||||||||||||||||||||||||||||||||||||