Microscopio electrónico de

Un microscopio electrónico de es un microscopio que utiliza un haz de acelerado electrones como una fuente de iluminación. Porque la longitud de onda de un electrón puede ser hasta 100.000 veces más corta que la de la luz visible fotones, el microscopio electrónico tiene una mayor poder de resolución que un microscopio de luz y puede revelar la estructura de objetos más pequeños. Microscopio electrónico de transmisión puede alcanzar más de 50pm resolución[1] y ampliaciones de hasta unos 10.000.000 x mientras que la mayoría Microscopios de luz están limitados por difracción de a unos 200nm resolución y aumentos útiles por debajo de 2000 x.
Los usos de microscopio electrónico de transmisión electrostático y electromagnética lentes para el control de los electrones de la viga y concentrarse para formar una imagen. Estos lentes ópticas electrones son análogos a las lentes de vidrio de un microscopio óptico de luz.
Microscopios se utilizan para investigar la ultraestructura de una amplia gama de especímenes biológicos e inorgánicos incluyendo microorganismos, células de, grandes moléculas de, biopsia de la muestras, metales, y cristales. Industrialmente, el microscopio electrónico es de uso frecuente para el control de calidad y Análisis de falla. Microscopios electrónicos modernos producen electrones micrografías utilizando cámaras digitales especializadas y grabbers del marco para capturar la imagen.
Contenido
- 1 Historia
- 2 Tipos de
- 2.1 Microscopio electrónico de transmisión (TEM)
- 2.2 Microscopio electrónico de barrido (SEM)
- 2.3 Color
- 2.4 Microscopio de reflexión (REM)
- 2.5 Análisis de microscopio electrónico de transmisión (vástago)
- 3 Preparación de la muestra
- 4 Desventajas
- 5 Aplicaciones
- 6 Véase también
- 7 Referencias
- 8 Enlaces externos
- 8.1 General
- 8.2 Historia
- 8.3 Otros
Historia


La primera lente electromagnética fue desarrollada en 1926 por Hans Busch.[2]
Según Dennis Gabor, el físico Leó Szilárd probado en 1928 para convencer a Busch para construir un microscopio electrónico, que había presentado una patente.[3]
Físico alemán Ernst Ruska y el ingeniero eléctrico Max Knoll construido el prototipo de microscopio electrónico en 1931, capaz de poder cuatrocientos aumentos; el aparato fue la primera demostración de los principios de la microscopía electrónica.[4] Dos años más tarde, en 1933, Ruska construyó un microscopio electrónico que supera la resolución alcanzable con un microscopio óptico (luz).[4] Por otra parte, Reinhold Rudenberg, el director científico de Siemens-Schuckertwerke, obtuvo la patente para el microscopio electrónico en mayo de 1931.
En 1932, Ernst Lubcke de Siemens & Halske construido y obtuvo imágenes de un microscopio de prototipo, aplicando conceptos descritos en las solicitudes de patentes de Rudenberg.[5] Cinco años más tarde (1937), la empresa financió el trabajo de Ernst Ruska y Bodo von Borriesy empleados Helmut Ruska (Hermano de Ernst) para desarrollar aplicaciones para el microscopio, especialmente con muestras biológicas.[4][6] También en 1937, Manfred von Ardenne fue pionero en la microscopio electrónico de barrido.[7] El primero práctica microscopio electrónico fue construido en 1938, en la Universidad de Toronto, por Eli Franklin Burton y estudiantes Cecil Hall, James Hilliery Albert Prebus; y Siemens produjo el primer comercial microscopio electrónico de transmisión (TEM) en 1939.[8] Aunque son capaces de aumento de potencia de 2 millones, como instrumentos científicos, microscopios electrónicos contemporáneos siguen siendo basados de Ruska prototipo de.
Tipos de

Microscopio electrónico de transmisión (TEM)
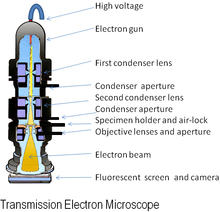
La forma original del microscopio electrónico, la microscopio electrónico de transmisión (TEM) utiliza una alto voltaje Haz de electrones para crear una imagen. El haz de electrones se produce por un arma de electrón, frecuentemente equipadas con un tungsteno filamento cátodo como la fuente de electrones. El haz de electrones es acelerado por una ánodo de por lo general en + 100 keV (40 a 400 keV) con respecto al cátodo, enfocado por electrostático y electromagnética lentes y transmitida a través de la muestra que es en parte transparente a los electrones y en la parte desparrama ellos fuera de la viga. Cuando emerge de la muestra, el haz de electrones lleva información sobre la estructura de la muestra que se magnifica por la lente del objetivo sistema del microscopio. La variación espacial de esta información (la "imagen") puede verse por proyectar la imagen magnificada del electrón sobre un fluorescente ver pantalla recubierta con un fósforo o scintillator materiales tales como sulfuro del cinc. Alternativamente, la imagen se puede grabar fotográficamente por exponer un película fotográfica o placa de directamente al electrón viga, o un fósforo de alta resolución puede acoplarse mediante un sistema óptico de lentes o un de fibra óptica Guía de luz en el sensor de un CCD (dispositivo de carga acoplada) cámara. La imagen detectada por el CCD puede visualizarse en un monitor o computadora.
Resolución de la temperatura está limitado principalmente por aberración esférica, pero una nueva generación de correctores de aberración han sido capaces de superar parcialmente aberración esférica para aumentar la resolución. Corrección de hardware de la aberración esférica para el microscopía electrónica de transmisión de alta resolución (HRTEM) ha permitido la producción de imágenes con resolución por debajo de 0.5 Angstrom (50 picometres)[1] y ampliaciones anteriores 50 millones de veces.[9] La capacidad para determinar las posiciones de átomos dentro de los materiales ha hecho el HRTEM una herramienta importante de investigación de nanotecnologías y desarrollo.[10]
Es un modo importante de utilización de TEM difracción de electrones. Las ventajas de la difracción de electrones sobre Cristalografía de rayos x son que la muestra no necesita ser un solo cristal o incluso un polvo policristalino, y también que el Fourier transforma de la reconstrucción del objeto de magnifica estructura ocurre físicamente y evita así la necesidad de resolver el problema de la fase que enfrentan los cristalógrafos de rayos x después de obtener los patrones de difracción de rayos x de un solo cristal o policristalino polvo. La desventaja principal del microscopio electrónico de transmisión es la necesidad de secciones muy delgadas de las muestras, por lo general alrededor de 100 nanómetros. Especímenes biológicos deben típicamente ser químicamente fijo, deshidratado y embebidos en una resina de polímero estabilizar suficientemente para permitir seccionamiento ultrafino. Secciones de especímenes biológicos, polímeros orgánicos y materiales similares pueden requerir un tratamiento especial con etiquetas átomo pesado para lograr el contraste de la imagen requerida.
Microscopio electrónico de barrido (SEM)

A diferencia de la temperatura, donde los electrones de la viga de alta tensión llevan la imagen de la muestra, el haz de electrones de la microscopio electrónico de barrido (SEM)[11] en ningún momento llevar una imagen completa de la muestra. El SEM produce imágenes mediante el análisis de la muestra con un haz de electrones enfocado que es analizado a través de un área rectangular de la muestra (la exploración de trama). Cuando el haz de electrones interactúa con la muestra, se pierde energía por una variedad de mecanismos. La energía perdida se transforma en otras formas tales como calor, emisión de electrones secundarios de baja energía y alta energía de retrodispersión de electrones, (emisión de luzCathodoluminescence) o Rayos x emisión, que proporcionan señales portadoras de información sobre las propiedades de la superficie de la muestra, tales como su topografía y composición. La imagen mostrada por un SEM asigna la intensidad variable de cualquiera de estas señales en la imagen en una posición correspondiente a la posición del haz sobre la muestra cuando se genera la señal. En la imagen de SEM de una hormiga que se muestra a la derecha, la imagen fue construida de señales producidas por un detector de electrones secundarios, normales o convencionales de modo en la mayoría de SEMs.
Generalmente, la resolución de la imagen de un SEM es al menos un orden de magnitud más pobre que la de un TEM. Sin embargo, porque la imagen de SEM se basa en procesos de superficie en lugar de transmisión, es capaz de las muestras a granel de imagen hasta muchos centímetros de tamaño (dependiendo de la configuración y diseño de instrumento) tiene una gran profundidad de campo y por lo tanto pueden producir imágenes que son buenas representaciones de la forma tridimensional de la muestra. Otra ventaja del SEM es la variedad llamada microscopio electrónico de barrido ambiental (ESEM) puede producir imágenes de suficiente calidad y resolución con las muestras se moje o contenida en bajo vacío o en gas. Esto facilita enormemente las muestras biológicas que son inestables en el alto vacío de los microscopios electrónicos convencionales de la proyección de imagen.
Color
En sus configuraciones más comunes, los microscopios electrónicos producen imágenes con un valor de brillo solo por píxel, con resultados generalmente representan en escala de grises.[12] Sin embargo, muchas veces estas imágenes son luego coloreadas mediante el uso de software de detección de función, o simplemente utilizando un editor de gráficos edición de mano. Esto es generalmente para un efecto estético o para clarificar la estructura y generalmente no aporta información sobre la muestra.[13]
En algunas configuraciones más información acerca de las propiedades de ejemplar se recopila por píxel, generalmente por el uso de detectores múltiples.[14] En SEM, los atributos de la topografía y el material de contraste pueden obtenerse por un par de detectores de electrones retrodispersados y tales atributos pueden se superponen en una imagen de color solo asignando un color primario diferente a cada atributo.[15] Del mismo modo, una combinación de dispersión y señales electrónica secundaria pueden ser asignadas a diferentes colores y superpuestas sobre una micrografía de solo color mostrando simultáneamente las propiedades de la muestra.[16]
En un método similar, detectores de electrones retrodispersados y electrónica secundaria se superponen y se asigna un color a cada una de las imágenes captadas por cada detector, con un resultado final de una imagen combinada de color que colores están relacionados con la densidad de los componentes. Este método es conocido como dependiente de la densidad color SEM (DDC-SEM). Micrografías por DDC-SEM retienen información topográfica, que es mejor capturada por el detector de electrones secundarios y combinan la información sobre densidad, obtenida por el detector de electrones retrodispersados.[17]

Algunos tipos de detectores utilizados en SEM de capacidades analíticas y pueden proporcionar varios elementos de datos en cada píxel. Ejemplos son la Espectroscopía de rayos x de energía dispersiva Detectores (EDS) utilizados en análisis elemental y Microscopio de la catodoluminiscencia Sistemas (CL) que analizan la intensidad y el espectro del electrón-inducido luminescencia en (por ejemplo) las muestras geológicas. En los sistemas de SEM con estos detectores es común a las señales de código de color y les superponer en una imagen de color único, por lo que las diferencias en la distribución de los distintos componentes de la muestra pueden ser vistas claramente y en comparación con. Opcionalmente, la imagen de electrones secundarios estándar se puede combinar con uno o más canales compositivos, por lo que pueden compararse con estructura y composición de la muestra. Este tipo de imágenes es posible manteniendo la integridad completa de la señal original, que no es modificada de alguna manera.
Microscopio de reflexión (REM)
En microscopio de reflexión (REM) como en el TEM, un haz de electrones es incidente sobre una superficie, pero en lugar de utilizar la transmisión (TEM) o electrones secundarios (SEM), el rayo reflejado de electrones dispersados elásticamente se detecta. Esta técnica es típicamente junto con difracción de electrones de alta energía de reflexión (RHEED) y Espectroscopia de energía pérdida de reflexión (RHELS). Otra variación es (microscopía de baja energía hacer girar-polarizadoSPLEEM), que se utiliza para observar la microestructura de Dominios magnéticos.[18]
Análisis de microscopio electrónico de transmisión (vástago)
Las madre las tramas una sonda incidente centrada a través de una muestra de que (como con el TEM) ha sido adelgazado para facilitar la detección de electrones dispersada a través de el espécimen. La alta resolución de la TEM es así posible en tallo. La acción enfoque (y las aberraciones) se producen antes los electrones de la muestra en el vástago, pero luego en la TEM. El uso de tallos de SEM-como viga rastering simplifica proyección de imagen de campo oscuro anulary otras técnicas analíticas, pero también significa que se adquirieron datos de imagen en serie en lugar de en paralelo. A menudo TEM puede ser equipado con la opción de escaneo y luego puede funcionar tanto como TEM y el tallo.
Preparación de la muestra

Materiales para ser visto bajo un microscopio electrónico pueden requerir tratamiento para producir una muestra adecuada. La técnica requerida varía dependiendo de la muestra y el análisis requerido:
- Producto químico fijación – fines de especímenes biológicos estabilizar la estructura macromolecular móvil del espécimen por reticulación química de proteínas con Aldehinos tales como formaldehído y glutaraldehído al, y lípidos con tetróxido de osmio.
- Tinción negativa -suspensiones que contengan nanopartículas o fino material biológico (como virus y bacterias) brevemente se mezclan con una solución diluida de una solución de electrón opaco como amonio molibdato, acetato de uranilo (o formato), o ácido fosfotúngstico. Esta mezcla es había aplicada a una red convenientemente revestida de EM, borrada, luego deja secar. Visualización de esta preparación en el TEM debe realizarse sin demora para obtener mejores resultados. El método es importante en Microbiología para la identificación morfológica rápida pero crudo, pero también puede utilizarse como base para la reconstrucción 3D de alta resolución metodología EM la tomografía cuando las películas de carbón se utilizan para la ayuda. Tinción negativa también se utiliza para la observación de las nanopartículas.
- Criofijación – congelar una muestra tan rápidamente, en etano líquidoy mantenido en nitrógeno líquido o incluso helio líquido temperaturas, por lo que las formas de agua vítreo hielo (no cristalino). Esto preserva a la muestra en una instantánea del estado de la solución. Un campo entero llamado microscopia del Cryo-electrón ha ramificado de esta técnica. Con el desarrollo de microscopia del Cryo-electrón de secciones vítreas (CEMOVIS), ahora es posible observar muestras de prácticamente cualquier muestra biológica cerca de su estado natal.[citación necesitada]
- Deshidratación – la liofilización, o la sustitución de agua con disolventes orgánicos tales como etanol o acetona, seguido por secado en punto crítico o la infiltración con incrustación resinas.
- Especímenes biológicos, inclusión – después de la deshidratación, tejido para observación en el microscopio electrónico de transmisión está integrado por lo que pueden ser seccionado listo para su visualización. Para ello el tejido pasa a través de un solvente de' transición' como Óxido de propileno (epoxipropano) y luego se infiltra con una epoxy resina tales como Araldite, Epon, o Durcupan;[19] los tejidos también pueden incrustarse directamente en miscible con agua resina de acrílico. Después de que la resina ha sido polimerizada (endurecido) la muestra es seccionadas finas (secciones ultrafinas) y manchado – entonces está listo para su visualización.
- Incrustación de materiales – después de empotrar en resina, la muestra es generalmente de tierra y pulida a un final mirror-like usando abrasivos ultrafinos. El proceso de pulido debe realizarse cuidadosamente para minimizar los arañazos y otros artefactos pulidos que reducen la calidad de la imagen.
- Remedo de metal Metal (p. ej. Platinum) es evaporado desde un electrodo superior y aplicado a la superficie de una muestra biológica en un ángulo. Esto es seguido por una disolución del material biológico en un baño ácido, dejando sólo la réplica superficial metálica intacto. Esta réplica superficial metálica entonces puede ser examinada usando microscopia electrónica de transmisión. Las variaciones en el grosor y el ángulo de la superficie del metal permite una imagen que se formará desde el incidente de electrones se dispersan en diferentes direcciones en lugar de pasar a través de él.
- De seccionamiento – produce rebanadas finas de la muestra, semitransparente para electrones. Estas pueden ser cortadas con un ultramicrótomo con un Diamond cuchillo para producir rebanadas ultra delgadas de 60-90 nm de espesor. Disponible vidrio cuchillos también se utilizan porque se puede hacer en el laboratorio y son mucho más baratos.
- La coloración – utiliza metales pesados tales como plomo, uranio o tungsteno dispersión de electrones y así dar contraste entre diferentes estructuras, ya que muchos materiales (sobre todo biológicos) son casi "transparentes" para electrones (objetos fase débil). En biología, especímenes pueden ser manchados "en bloque" antes de incrustar y también después de seccionamiento. Típicamente las secciones finas se tiñen durante varios minutos con una solución acuosa o alcohólica de acetato de uranilo seguido por citrato de plomo acuoso.
- Fractura de congelación o congelación-etch – un método de preparación particularmente útil para examinar las membranas del lípido y sus proteínas incorporadas en "cara en" vista. La suspensión fresca de tejido o célula es congelada rápidamente (criofijación), fracturó entonces simplemente rompiendo o mediante un micrótomo mientras mantenga a temperatura de nitrógeno líquido. La fría superficie de fractura (a veces "grabado" mediante el aumento de la temperatura sobre −100 ° C durante varios minutos para dejar algunos sublime de hielo) entonces es sombreado con evaporada platinum o gold en un ángulo promedio de 45° en un evaporador de vacío alto. Una segunda capa de carbono evaporado perpendicular al plano superficial promedio se realiza con frecuencia para mejorar la estabilidad de la capa de réplica. La muestra se vuelve a temperatura ambiente y presión, entonces la fragilidad réplica de "la sombra" metal de la superficie de fractura es liberada de la materia biológica subyacente por cuidadosa digestión química con ácidos, hipoclorito de solución o SDS detergente. La réplica flotante todavía es completamente lavada libre de productos químicos residuales, cuidadosamente pescaban en finas rejillas, secada entonces han consultado en la TEM.
- Viga de ion que muele -diluye las muestras hasta que se transparente a los electrones por el disparo iones (por lo general argón) en la superficie de un material ángulo y pulverización de la superficie. Es una subclase de esta centrado de la viga de ion fresado, donde Galio los iones se utilizan para producir una membrana transparente del electrón en una región específica de la muestra, por ejemplo a través de un dispositivo dentro de un microprocesador. Viga de ion fresado puede usarse también para el pulido de sección antes del análisis de SEM de los materiales que son difíciles de preparar con pulido mecánico.
- Capa conductora – una capa ultrafina de eléctricamente realización material, depositado por evaporación al alto vacío o por sputter de vacío bajo la capa de la muestra. Esto se hace para evitar la acumulación de campos eléctricos estáticos en la muestra debido a la irradiación del electrón durante la proyección de imagen. Los materiales de revestimiento incluyen oro, oro/paladio, platino, tungsteno, grafito, etc..
- Puesta a tierra – para evitar la acumulación de carga eléctrica en una conductor muestra cubierta, generalmente eléctricamente está conectado con el portamuestras metálico. A menudo un adhesivo conductivo se utiliza para este propósito.
Desventajas

En la foto: Primer grado filtro de pelos con forma de V de segundo grado pelos apuntando hacia el interior de la cesta de alimentación. La bola púrpura es 1 µm de diámetro.
Los microscopios electrónicos son costosos construir y mantener, pero los costos de capital y corrientes microscopía confocal los sistemas ahora se traslapa con los microscopios electrónicos básicos. Microscopio diseñado para conseguir altas resoluciones debe ubicado en edificios estables (a veces subterráneos) con servicios especiales como campo magnético anular sistemas.
Las muestras en gran parte tienen que ver en vacío, como las moléculas de aire dispersan los electrones. Una excepción es ambiental microscopio electrónico de barrido, que permite muestras hidratadas en una baja presión (hasta 20Torr o 2.7 kPa) o ambiente húmedo.
Microscopios electrónicos de barrido operando en modo alto vacío convencional generalmente la imagen muestras conductoras; por lo tanto, materiales no conductores requieren capa conductora (aleación de oro/paladio, osmio, carbono, etc.). El modo de baja tensión de los microscopios modernos hace posible la observación de muestras no conductoras sin recubrimiento. Materiales no conductores pueden ser también reflejada por una presión variable (o ambiental) microscopio electrónico de barrido.
Especímenes pequeños, estables nanotubos de carbono, diatomeas frustules y pequeños cristales de mineral (fibras de amianto, por ejemplo) no requieren ningún tratamiento especial antes de ser examinado en el microscopio electrónico. Muestras de materiales hidratados, incluyendo a casi todas las muestras biológicas tienen que estar preparados de diversas maneras para estabilizarlos, reducir su espesor (seccionamiento ultrafino) y aumentar su contraste óptico de electrones (manche). Estos procesos pueden resultar en artefactos, pero estos generalmente pueden identificarse comparando los resultados obtenidos mediante el uso de métodos de preparación de muestra radicalmente diferentes. Generalmente es creído por los científicos que trabajan en el campo que como resultados de la preparación de varias técnicas han sido comparados y que no hay ninguna razón que todos deben producen artefactos similares, es razonable creer que la microscopia electrónica características corresponden con los de las células vivas. Desde la década de 1980, análisis de cryofixed, especímenes vitrificados también ha convertido cada vez más utilizado por científicos, confirmando aún más la validez de esta técnica.[20][21][22]
Aplicaciones
Biología y Ciencias de la vida
|
|
Véase también
- Imágenes de microscopio de electrón: categoría
- Acrónimos en microscopia
- Difracción de electrones
- Espectroscopia de la pérdida de energía electrónica (ANGUILAS)
- Microscopía electrónica de transmisión energía filtrada (EFTEM)
- Microscopio electrónico de barrido ambiental (ESEM)
- Microscopio de emisión de campo
- HiRISE
- Microscopia electrónica in situ
- Procesamiento de imágenes de microscopio
- Microscopia
- Nanociencia
- Nanotecnología
- Microscopio de neutrones
- Microscopía confocal de la exploración
- Microscopio electrónico de barrido (SEM)
- Microscopio de efecto túnel
- Ciencia de superficies
- Transmisión microscopio aberración-corregido
- Difracción de rayos x
- Microscopio de rayos x
Referencias
- ^ a b Erni, Rolf; Rossell, MD; Kisielowski, C; Dahmen, U (2009). "Atómico-resolución de imagen con una sonda electrónica de Sub-50-pm". Letras físicas de la revisión 102 (9): 096101. Bibcode:2009PhRvL.102i6101E. doi:10.1103/PhysRevLett.102.096101. PMID19392535.
- ^ Mathys, Daniel, Zentrum für Mikroskopie, Universidad de Basilea: Die Entwicklung der Elektronenmikroskopie vom Bild über die Analyse zum Nanolabor, p. 8
- ^ Dannen, Gene (1998) Leo Szilard el Inventor: un Slideshow (1998, Budapest, Conferencia charla). Dannen.com
- ^ a b c Ruska, Ernst (1986). "Autobiografía de Ernst Ruska". Fundación Nobel. 2010-01-31.
- ^ Rudenberg, Gunther H y Rudenberg, Pablo G (2010). "Capítulo 6 – origen y antecedentes de la invención del microscopio electrónico: Comentario y notas ampliadas en memoria de Reinhold Rüdenberg". Avances en proyección de imagen y electrónica física 160. Elsevier. doi:10.1016/S1076-5670 (10) 60006-7. ISBN978-0-12-381017-5.
- ^ Kruger DH; Schneck P; Gelderblom HR (mayo de 2000). Helmut Ruska y la visualización de los virus. Lanceta 355 (9216): 1713-7. doi:10.1016/S0140-6736 (00) 02250-9. PMID10905259.
- ^ von Ardenne, M y Beischer, D (1940). "Untersuchung von metalloxyd-rauchen mit dem universal-elektronenmikroskop". Zeitschrift Electrochemie (en alemán) 46:: 270-277.
- ^ "James Hillier". Inventor de la semana: archivo. 2003-05-01. 2010-01-31.
- ^ "La escala de las cosas". Oficina de ciencias básicas de energía, Departamento de energía de Estados Unidos. 2006-05-26. 2010-01-31.
- ^ O ' Keefe MA, Allard LF. "Microscopia electrónica de sub-Ångstrom para Sub-Ångstrom Nano-metrología" (PDF). Puente de la información: DOE información científica y técnica – patrocinado por OSTI. 2010-01-31.
- ^ McMullan D (1993). "Análisis de microscopia electrónica, 1928-1965". 51 reunión anual de la sociedad de microscopía de América. Cincinnati, OH. 2010-01-31.
- ^ Burgess, Jeremy (1987). Bajo el microscopio: un mundo oculto revelado. Archivo de la Copa. p. 11. ISBN0521399408.
- ^ "Introducción a la microscopia electrónica" (PDF). FEI Company. p. 15. 12 de diciembre 2012.
- ^ Antonovsky, A. (1984). "La aplicación de color a la imagen de la sem para la determinación del aumentada". Micrones y Acta Microscopica 15 (2): 77 – 84. doi:10.1016/0739-6260 (84) 90005-4.
- ^ Danilatos, G.D. (1986). «Color micrográfos de electrón de backscattered señales en el SEM». La exploración 9 (3): 8 – 18. doi:10.1111/j.1365-2818.1986.tb04287.x.
- ^ Danilatos, G.D. (1986). "Microscopía electrónica de barrido de color de medio ambiente". J. microscopía 142:: 317-325. doi:10.1002/SCA.4950080104.
- ^ a b Bertazzo, S.; Caballero, E.; Cloyd, k. L.; Chester, A. H.; Yacoub, M. H.; Stevens, M. M. (2013). "Nano-analítico la microscopia electrónica revela penetraciones fundamentales en la calcificación del tejido cardiovascular humana". Materiales de la naturaleza 12 (6): 576-583. Bibcode:2013NatMa... 12..576B. doi:10.1038/nmat3627. PMID23603848.
- ^ «SPLEEM». Centro Nacional de microscopía (NCEM). 2010-01-31.
- ^ Luft, J.H. (1961). "Mejoras en la resina de epoxy incrustar los métodos". El diario de citología Biofísica y bioquímica 9 (2). p. 409. PMC2224998. PMID13764136.
- ^ Adrián, Marc; Dubochet, Jacques; Lepault, Jean; McDowall, Alasdair W. (1984). "Microscopia del Cryo-electrón de virus". Naturaleza 308 (5954): 32 – 36. Bibcode:1984Natur.308... 32A. doi:10.1038/308032a0. PMID6322001.
- ^ Sabanay, I.; Arad, T.; Weiner, S.; Geiger, B. (1991). "Estudio de secciones de tejido congelado vitrificados, sin manchas por microscopía de cryoimmunoelectron". Diario de la ciencia celular 100 (1): 227-236. PMID1795028.
- ^ KASAS, S.; Dumas, G.; Dietler, G.; Catsicas, S.; Adrián, M. (2003). "Vitrificación de muestras de microscopia de cryoelectron revelados por proyección de imagen fotográfica de alta velocidad". Diario de la microscopia 211 (1): 48 – 53. doi:10.1046/j.1365-2818.2003.01193.x.
Enlaces externos
| Recursos de la biblioteca Acerca de Microscopia electrónica |
|
| Campos comunes de Wikimedia tiene medios relacionados con Imágenes de microscopio electrónico. |
- Una introducción al microscopio electrónico Recursos para profesores y estudiantes
- Ayuda de la ciencia: la microscopia electrónica Recursos de secundaria (GCSE, A Level)
- Centrado la base de datos – datos de microscopia electrónica de células
General
- Galería de imágenes de Nanohedron.com|nano hermosas imágenes generadas con microscopios electrónicos.
- microscopia electrónica Sitio web de la ETH de Zurich: muy buenos gráficos e imágenes, que ilustran diversos procedimientos.
- Concurso de imagen FEI FEI tiene un concurso de imagen del microscopio cada año desde 2008.
- Microscopio electrónico de barrido ambiental (ESEM)
- Elemento análisis en microscopio de la radiografía Portal la información con microanálisis de la radiografía y contenido EDX
- Seminario de Eva Nogales: "Introducción a la microscopia electrónica"
- buena introducción a la microscopia electrónica por David Szondy
Historia
Recuerdos de John H L Watson de la Universidad de Toronto cuando él trabajó con Hillier y Prebus: [1]
- Colección de microscopia electrónica de Rubin Borasky, 1930-1988 Centro de archivos, Museo Nacional de historia americana, institución Smithsonian.
Otros
- La sociedad microscópica real, sección de microscopía electrónica (Reino Unido)
- Albert Lleal. Temas de historia natural en el microscopio electrónico de barrido SEM
|