Dispositivo de asistencia ventricular
| Dispositivo de asistencia ventricular | |
|---|---|
| Intervención | |

Ventricular izquierda asisten a dispositivo (DAVI) bombeando sangre desde el ventrículo izquierdo a la aorta, conectada con un paquete de batería y unidad de control externamente desgastadas.
|
|
| MedlinePlus | 007268 |
A dispositivo de asistencia ventricular (VAD) es un electromecánicos aparato circulatorio que se utiliza para sustituir a la función de un defecto parcial o totalmente corazón. La función de VADs difiere de marcapasos artificiales. Algunos VADs están diseñados para uso a corto plazo, típicamente para los pacientes que se recuperan de ataques al corazón o cirugía cardíaca, mientras que otros están diseñados para uso a largo plazo (meses y años y en algunos casos para toda la vida), típicamente para pacientes que sufren de avanzada insuficiencia cardíaca congestiva.
VADs son distintos de corazones artificiales, que están diseñados para apoderarse completamente de la función cardiaca y generalmente requieren el retiro del corazón del paciente. VADs están diseñados para ayudar a (RVAD) o a la izquierda (DAVI) ventrículo, o ambas cosas a la vez (BiVAD). El tipo que se usa depende principalmente de la subyacente enfermedades del corazón y la resistencia arterial pulmonar que determina la carga en el ventrículo derecho.
Trasplantar es más comúnmente utilizados, pero cuando la resistencia arterial pulmonar es alta, asistencia ventricular derecha puede ser necesario. A largo plazo VADs se utilizan normalmente para mantener a los pacientes con una buena calidad de vida mientras esperan un trasplante de corazón (conocido como un "puente al trasplante"). Sin embargo, VAD se utiliza a veces como terapia de destino, lo que significa que nunca serán sometido a trasplante de corazón y a veces como un puente hacia la recuperación.[1][2]
En los últimos años, VADs han mejorado significativamente en cuanto a la prestación de supervivencia y calidad de vida entre los destinatarios.[3]
Contenido
- 1 Diseño
- 1.1 Bombas
- 2 Historia
- 3 Estudios y resultados
- 3.1 Acontecimientos recientes
- 3.2 Estudio fundamental de HeartMate II Davi
- 3.3 ARPAS
- 3.4 REVANCHA
- 4 Complicaciones y efectos secundarios
- 5 Lista de dispositivos implantables de VAD
- 6 Véase también
- 7 Referencias
- 8 Enlaces externos
Diseño
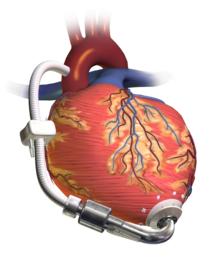
Bombas
El bombas utilizado en VADs pueden dividirse en dos categorías principales – bombas pulsátiles, que imitan la acción de pulsación natural del corazón, y un flujo continuo.[4] Uso de VADs pulsátil bombas de desplazamiento positivo. En algunas de estas bombas, el volumen ocupado por sangre varía durante el ciclo de bombeo, y si la bomba está contenida dentro del cuerpo entonces un tubo de ventilación para el aire exterior es necesario.
Flujo continuo VADs son menores y han demostrado para ser más durable que VADs pulsátiles.[5] Normalmente usan ya sea un bomba centrífuga o un bomba de flujo axial. Ambos tipos tienen un rotor central que contiene imanes permanentes. Corrientes eléctricas controladas a través de las bobinas contenidas en la carcasa de la bomba aplican fuerzas a los imanes, que a su vez causan los rotores para girar. En las bombas centrífugas, los rotores son formados para acelerar la sangre circunferencial y tal modo provocar que se mueva hacia el borde exterior de la bomba, mientras que en las bombas de flujo axial los rotores son más o menos cilíndricos con hojas que son helicoidales, causando la sangre ser acelerado en la dirección del eje del rotor.[6]
Un tema importante con las bombas de flujo continuo es el método utilizado para suspender el rotor. Las primeras versiones utilizan cojinetes sólidos; Sin embargo, las bombas más nuevas, algunos de los cuales están aprobados para su uso en la UE, utilizan cualquier suspensión electromagnética ("maglev")[7][8][9][10] o suspensión hidrodinámica. Estas bombas contienen solamente una pieza móvil.[citación necesitada]
Historia
La primera implantación exitosa a largo plazo de un LVAD artificial fue realizada en 1988 por el Dr. William F. Bernhard de Hospital Medical Center del niños y Thermedics, Inc. de Woburn, MA bajo un contrato de investigación de institutos nacionales de salud (NIH), que se convirtió en compañero de corazón, una controlada electrónicamente a dispositivo. Esto fue financiado por un contrato de $ 6,2 millones al Hospital Thermedics e infantiles, Boston MA de la National Heart y Lung and Blood Institute, un programa de NIH de tres años.[11] Las tempranas VADs emulan el corazón mediante una acción "pulsátil" donde sangre es succionado por la bomba desde el ventrículo izquierdo alternativamente luego expulsada hacia la aorta. Los dispositivos de este tipo incluyen el HeartMate IP LVAS, que fue aprobado para su uso en los Estados Unidos por la Food and Drug Administration (FDA) en octubre de 1994. Estos dispositivos se refieren comúnmente como primera generación VADs.[citación necesitada]
El trabajo más reciente se ha concentrado en las bombas de flujo continuo, que más o menos pueden ser categorizadas como tampoco bombas centrífugas o flujo axial impulsor bombas conducidas. Estas bombas tienen la ventaja de una mayor simplicidad, resultando en un tamaño más pequeño y una mayor fiabilidad. Estos dispositivos se conocen como segunda generación VADs. Un efecto secundario es que el usuario no tendrá un pulso, o que la intensidad del pulso se reducirá en serio.
Tercera generación VADs suspensión el impulsor de la bomba mediante suspensión hidrodinámica o electromagnética, así eliminando la necesidad de los cojinetes y reduciendo el número de piezas móviles a uno.[citación necesitada]
Otra tecnología sometidos a ensayos clínicos es el uso de trans cutánea inducción para encender y controlar el dispositivo en lugar de usar cables percutáneos. Aparte de la obvia ventaja estética y disminuye el riesgo de infección y la consecuente necesidad de tomar medidas preventivas. Una bomba pulsátil mediante esta tecnología tiene aprobación de la marca CE y está en ensayos clínicos para la aprobación de la FDA.[citación necesitada]
Un enfoque muy diferente en las primeras etapas de desarrollo es el uso de un manguito inflable alrededor de la aorta. Inflar el manguito contrae la aorta y desinflar el manguito permite ampliar la aorta – en efecto la aorta se convierte en un segundo ventrículo izquierdo. Un refinamiento propuesto es el uso del músculo esquelético del paciente, impulsado por un marcapasos, para alimentar este dispositivo que sería verdaderamente autónomo. Sin embargo un similar (operacióncardiomyoplasty) se intentó en los años 90 con resultados decepcionantes. En cualquier caso, tiene sustanciales ventajas potenciales en evitar la necesidad de operar en el corazón y en evitar cualquier contacto entre la sangre y el dispositivo. Este enfoque implica un retorno a un flujo pulsátil.[citación necesitada]
Peter Houghton recibió el mayor sobreviviente de una VAD para uso permanente. Recibió un Jarvik 2000 LVAD experimental en junio de 2000. Desde entonces, él completó una caminata de caridad 91 millas, publicó dos libros, conferencias ampliamente, excursión en los Alpes suizos y el oeste americano, voló en un avión ultraligero y viajado extensamente alrededor del mundo. Murió de insuficiencia renal aguda en 2007 a la edad de 69.[12][13]
Estudios y resultados
Acontecimientos recientes
- En julio de 2009 en Inglaterra, los cirujanos quitar el corazón de un donante que había sido implantado en un niño junto a su corazón nativo, después de que había recuperado su corazón nativo. Esta técnica sugiere dispositivo mecánico de asistencia, como por ejemplo un LVAD, puede tomar algunos o todos los trabajos lejos del corazón nativo y permita tiempo para sanar.[14]
- En julio de 2009, 18 meses seguimiento resultados del ensayo clínico HeartMate II concluyeron que Davi de flujo continuo proporciona apoyo hemodinámico eficaz durante al menos 18 meses en espera de trasplante, con mejor estado funcional y calidad de vida de los pacientes. (véase abajo).[15]
- Hospital de la Universidad de Heidelberg informó en julio de 2009 que implantó la primera HeartAssist5, conocida como la versión moderna de la VAD DeBakey, allí. El HeartAssist5 pesa 92 gramos, está hecho de titanio y plástico y sirve para bombear la sangre desde el ventrículo izquierdo a la aorta.[16]
- Una fase es un ensayo clínico en curso (a partir de agosto de 2009), consistiendo en pacientes con injerto de bypass de arteria coronaria y los pacientes en fase final de la insuficiencia cardiaca con un dispositivo de asistencia ventricular izquierda. El juicio involucra a prueba un parche, llamado Anginera(TM) que contiene las células que secretan factores de crecimiento similares a las hormonas que estimulan otras células para crecer. Los parches son sembrados con las células musculares cardíacas y luego implantados en el corazón, con el objetivo de conseguir las células musculares para comenzar a comunicarse con los tejidos nativos de una manera que permite contracciones regulares.[17][18]
- En septiembre de 2009, una Nueva Zelanda noticieros, cosas, informaron que dentro de 18 meses a dos años, un nuevo dispositivo inalámbrico estará listo para el ensayo clínico que accionará VADs sin contacto dirigen. Si tiene éxito, esto puede reducir las probabilidades de infección debido al cable de alimentación a través de la piel.[19]
- Los institutos nacionales de salud (NIH) otorgó un subsidio de $ 2,8 millones para desarrollar un corazón artificial total "pulso-less" utilizando dos VADS por Micromed, creada inicialmente por Michael DeBakey y George Noon. La concesión fue renovada por un segundo año de la investigación en agosto de 2009. El corazón Artificial Total fue creado usando dos HeartAssist5 VADs, por el que uno VAD bombas de sangre en todo el cuerpo y el otro circula sangre desde y hacia los pulmones.[20]
- HeartWare International anunció en agosto de 2009 que lo había superado los 50 implantes de su sistema de asistencia Ventricular HeartWare en su ensayo clínico anticipado, un estudio aprobado por la FDA IDE. El estudio es evaluar el sistema como puente al trasplante del sistema para los pacientes con fallo cardíaco en fase final. El estudio, evaluación del sistema de Davi HeartWare para el tratamiento de avance insuficiencia cardíaca, es un estudio multicéntrico que se inició en mayo de 2009.[21][22]
- 27 de junio de 2014 Hannover Medical School en Hannover, Alemania realizó el primer implante de HeartMate III humano bajo la dirección del profesor Axel Haverich M.D., jefe del cirujano cardiotorácico, trasplante y Departamento de Cirugía Vascular y cirujano Jan Schmitto, M.D., pH.d. >[23]
La mayoría de VADs en el mercado hoy en día es un poco voluminosa. El más pequeño dispositivo aprobado por la FDA, el HeartMate II, pesa aproximadamente 1 libra (0,45 kg) y mide 3 pulgadas (7,6 cm). Esto ha demostrado ser particularmente importante para mujeres y niños, para quienes alternativas habría sido demasiado grandes.[24]
Un dispositivo ganado la aprobación de la marca CE para su uso en la UE y comenzaron los ensayos clínicos en los Estados Unidos (VentrAssist). A partir de junio de 2007 estas bombas habían sido implantadas en más de 100 pacientes. En 2009, Ventracor fue puesta en manos de administradores debido a problemas financieros y fue más tarde ese año liquidado. No hay otras empresas adquirir la tecnología, así como resultado el VentrAssist dispositivo era esencialmente difunto. Unos 30 – 50 pacientes en todo el mundo siguen siendo compatibles con los dispositivos VentrAssist a partir de enero de 2010.[citación necesitada]
El Heartware HVAD funciona de forma similar a los VentrAssist – aunque mucho más pequeño y no requieren una bolsa abdominal que se implanta en. El dispositivo ha obtenido la marca CE en Europa, y la aprobación del FDA en los Estados Unidos recientemente, se ha demostrado que la Heartware HVAD puede ser implantado a través de un acceso limitado sin esternotomía.[25]
En un pequeño número de casos de asistencia ventricular izquierda dispositivos, combinados con terapia de droga, han permitido recuperar suficientemente para que el dispositivo para poder ser eliminado (el corazónexplantados).[1][2]
Estudio fundamental de HeartMate II Davi
Una serie de estudios que involucran el uso de la de HeartMate II Davi han demostrado ser útiles para establecer la viabilidad y riesgos del uso de trasplantar para terapia puente al trasplante y destino.
- El juicio por el HeartMate II LVAS piloto comenzó en noviembre de 2003 y consistió en estudio 46 pacientes en 15 centros. Resultados incluyeron a 11 pacientes apoyados por más de un año y tres pacientes apoyados durante más de dos años.
- El HeartMate II ensayo pivotal comenzó en el año 2005 e incluyó la evaluación de HeartMate II de dos indicaciones: puente al trasplante (BTT) y terapia de destino (DT) o a largo plazo y permanente apoyo. THORATEC Corp. anunció que esta era la primera vez la FDA había aprobado un ensayo clínico para incluir ambas indicaciones en un protocolo.[26][27][28]
- Un estudio multicéntrico en los Estados Unidos desde 2005 a 2007 con 113 pacientes (de los cuales 100 informaron medidas de resultado principales) demostró que mejoras significativas en la función eran frecuentes después de tres meses y una tasa de supervivencia del 68% después de doce meses.[29]
- Basado en un año de seguimiento datos de los primeros 194 pacientes inscritos en el juicio, la FDA aprobó HeartMate II para el puente al trasplante. El ensayo aportó pruebas clínicas de las tasas de mejoría en la supervivencia y calidad de vida para una amplia gama de pacientes.[30][31]
- Dieciocho meses de seguimiento datos sobre 281 pacientes que habían alcanzado el punto final del estudio o completar 18 meses de seguimiento postoperatorio mostró mejoría en la supervivencia, menos eventos adversos frecuentes y una mayor fiabilidad con flujo continuo trasplantar en comparación a los dispositivos de flujo pulsátil. De los 281 pacientes, 157 pacientes habían experimentado el trasplante, 58 pacientes continuaban con VAD en su cuerpo y siete pacientes tenían el Davi eliminado porque su corazón recuperados; el restante 56 había muerto. Los resultados mostraron que la clase NYHA de insuficiencia cardiaca, que los pacientes habían sido designados habían mejorado significativamente después de seis meses de apoyo Davi comparado con la línea de base pre-Davi. Aunque este juicio implicó indicación puente al trasplante, los resultados proporcionan evidencia preliminar que trasplantar un flujo continuo tiene ventajas en términos de durabilidad y fiabilidad para los pacientes que reciben soporte mecánico para la terapia de destino.[32]
- Tras la aprobación de la FDA de HeartMate II Davi fines puente al trasplante, se realizó un estudio posteriores a la homologación ("registro") para evaluar la eficacia del dispositivo en un entorno comercial. El estudio encontró que el dispositivo mejorado los resultados, ambos en comparación con otros tratamientos Davi y pacientes de línea de base. En concreto, HeartMate II los pacientes mostraron niveles más bajos de creatinina, tasas de supervivencia a 30 días fueron considerablemente superiores al 96% y 93% alcanzado resultados exitosos (trasplante, recuperación cardiaca o Davi a largo plazo).[33]
ARPAS
El estudio de protocolo de recuperación de Harefield (arpas) es un ensayo clínico para evaluar si la avanzada insuficiencia cardíaca pacientes VAD que requieren apoyan puede recuperar la función del miocardio suficiente para permitir la extracción del dispositivo (conocido como destete). ARPAS combina un LVAD (el HeartMate XVE) con medicamentos convencionales oral insuficiencia cardíaca, seguidos por el novela β2 agonista clenbuterol. Esto abre la posibilidad que algunos pacientes con insuficiencia cardíaca avanzada pueden renunciar al trasplante cardiaco.[34]
Hasta la fecha, el 73% (11 de 15) de pacientes que experimentaron el régimen de terapia de combinación demostró recuperación suficiente para permitir una explantación y evitar el trasplante del corazón; libertad de insuficiencia cardíaca recurrente en pacientes supervivientes fue 100% y 89% a uno y cuatro años después de destete, respectivamente; fracción de eyección promedio fue de 64% a 59 meses después del destete – todos los pacientes eran clase NYHA I; y efectos adversos significativos no fueron registrados con terapia del clenbuterol.
REVANCHA
El ensayo clínico de revancha (Randomized evaluación de asistencia mecánica para el tratamiento de la insuficiencia cardíaca) comenzó en mayo de 1998 y corrió a través de julio de 2001 en 20 centros de trasplante cardiaco alrededor de los Estados Unidos. El ensayo fue diseñado para comparar la implantación a largo plazo de los dispositivos de asistencia ventricular izquierda con el tratamiento médico óptimo para los pacientes con insuficiencia cardíaca final que requieren, pero que no califican para recibir el trasplante cardiaco. Como consecuencia de los resultados clínicos, el dispositivo recibió la aprobación del FDA para ambas indicaciones, en 2001 y 2003, respectivamente.[35]
El ensayo demostró una mejora del 81% en dos años la supervivencia entre los pacientes que recibieron HeartMate XVE comparado con el tratamiento médico óptimo. Además, una terapia de destino estudio siguiendo el ensayo revancha demostró una mejora adicional del 17% (61% vs. 52%) en un año la supervivencia de los pacientes que fueron implantados con una VAD (HeartMate XVE), con una implicación para la selección apropiada de los candidatos y el calendario de implantación de VAD.
Una prueba realizada en 2001 por el Dr. Eric A. Rose y grupo de estudio de revancha con los pacientes con insuficiencia cardíaca congestiva que eran elegibles para un trasplante demostrado una supervivencia a los dos años del 23% para aquellos implantados con un LVAD comparado con 8% de aquellos que fueron tratados con medicamentos. Las dos principales complicaciones de implantación VAD fueron infección y fallas mecánicas (véase abajo).
Según un estudio de cohorte retrospectivo comparando los pacientes tratados con ventricular izquierda asistir a dispositivo versus tratamiento inotrópico espera de trasplante cardiaco, el grupo tratado con Davi había mejorado la función metabólica y clínica en el momento del trasplante con mejor la presión arterial, sodio, creatinina y nitrógeno ureico en sangre. Después del trasplante, 57,7% del grupo de apoyo inotrópico tenían insuficiencia renal frente al 16,6% en el grupo Davi; 31,6% del grupo de apoyo inotrópico tenía insuficiencia cardíaca derecha frente al 5,6% en el grupo Davi; y supervivencia libre de eventos fue 15,8% en el grupo de apoyo inotrópico versus 55,6% en el grupo Davi.[36]
Complicaciones y efectos secundarios
Las complicaciones hemorrágicas postoperatorias tempranas son una causa importante de morbilidad y reintervenciones en pacientes Davi.[37] El sangrado es la complicación más común de temprana postoperatoria después de la implantación o explantation de trasplantar, necesitando reintervención en hasta un 60% de los destinatarios.[38] Las implicaciones de transfusiones masivas de sangre son grandes e incluyen infección, insuficiencia pulmonar, aumento de los costos, insuficiencia cardíaca derecha, allosensitization y transmisión viral, algunas de las cuales pueden ser fatal o impedir el trasplante.[38] Cuando se produce la hemorragia, impacta el año una mortalidad de Kaplan-Meier.[37] Además de la complejidad de la población de pacientes y la complejidad de estos procedimientos contribuyen a la sangría, los dispositivos se pueden contribuir a la coagulopatía severa que puede sobrevenir cuando se implantan estos dispositivos.[39] Crítica en el tratamiento del sangrado en las primeras horas después de la implantación o destete es evacuar adecuadamente la sangre post-quirúrgicos alrededor del corazón y los pulmones para impedir que la sangre conservada contribuyendo a la necesidad de reintervención lavar coágulos que pueden comprimir las características del dispositivo y contribuir al shock post operatorio. Prevención tubo torácico obstrucción durante este periodo es fundamental para la recuperación.[38]
Porque los dispositivos generalmente resultan en la sangre que fluye sobre una superficie no-biológicos, predisponiendo la sangre coagulación, no hay necesidad de anticoagulación medidas. Un dispositivo, el HeartMate XVE, está diseñado con una superficie biológica derivada de fibrina y no requiere anticoagulación a largo plazo (excepto aspirina); Desafortunadamente, esta superficie biológica también puede predisponer al paciente a la infección a través de la reducción selectiva de ciertos tipos de leucocitos.[40]
Nuevos diseños VAD que ahora están aprobados para su uso en la Comunidad Europea y se someten a ensayos para la aprobación de la FDA tienen fallas mecánicas eliminado todo.[citación necesitada]
Infección relacionada con el VAD puede ser causada por un gran número de diferentes organismos:[41]
- (Gramo) bacterias grampositivasEstafilococos, especialmente Estafilococo. aureus, Enterococos)
- (Gramo) las bacterias gramnegativasPseudomonas aeruginosa, Enterobacter especies, Klebsiella especies)
- Hongos. especialmente Candida especies
Tratamiento de la infección relacionada con el VAD es sumamente difícil y muchos pacientes mueren de infección a pesar de un tratamiento óptimo. El tratamiento inicial debe ser con antibióticos de amplio espectro, pero deben hacerse todos los esfuerzos para obtener muestras adecuadas para el cultivo. Una decisión definitiva con respecto a la terapia antibiótica debe basarse en los resultados de las culturas microbiogical.[citación necesitada]
Otros problemas incluyen inmunosupresión, con el movimiento resultante de coagulación y sangrado secundario a la anticoagulación. Algunos de los poliuretano los componentes utilizados en los dispositivos de causan la supresión de un subconjunto de células inmunes Cuando la sangre entra en contacto con ellos. Esto predispone al paciente a fungicida y algunos viral infecciones que apropiado terapia profiláctica.[42]
Lista de dispositivos implantables de VAD
Esta es una lista parcial y nunca puede ser completa
Las adiciones que se hace referencia son bienvenidas
| Dispositivo | Fabricante | Tipo | Estado de aprobación a partir de julio de 2010 |
|---|---|---|---|
| Novacor | Mundo corazón | Pulsátil. | Fue aprobado para su uso en América del norte, la Unión Europea y Japón. Ya desaparecida y ya no soportados por el fabricante. (Heartware completó adquisición de agosto de 2012) |
| HeartMate XVE | THORATEC | Pulsátil | Aprobación de la FDA para BTT en 2001 y DT en 2003. Autorizado de la marca CE. Rara vez se utiliza más debido a problemas de fiabilidad. |
| HeartMate II | THORATEC | Rotor conducido continuos rodamientos axiales flow, bola y copa. | Aprobado para su uso en América del norte y la Unión Europea. Autorizado de la marca CE. Aprobación de la FDA para BTT en abril de 2008. Recientemente aprobado por la FDA en los Estados Unidos para la terapia de destino (como sucedió en enero de 2010). |
| HeartMate III | THORATEC | Flujo continuo impulsado por un rotor magnético suspendido flujo axial. | Ensayos pivotales de HeartMate III comenzaron en el año 2014. |
| INCOR | Corazón de Berlín | Flujo continuo impulsado por un rotor magnético suspendido flujo axial. | Aprobado para su uso en la Unión Europea. Para aprobaciones humanitarias sobre la base de caso por caso en los Estados Unidos. Entró en ensayos clínicos en los Estados Unidos en 2009. |
| EXCOR pediátrico | Corazón de Berlín | Dispositivo de membrana externa bomba diseñada para niños. | Aprobado para su uso en la Unión Europea. FDA concedió exención de dispositivo humanitario para nosotros en diciembre de 2011. |
| Jarvik 2000 | Corazón Jarvik | Flujo continuo, rotor axial apoyado por rodamientos cerámicos. | Utiliza actualmente en los Estados Unidos como puente al trasplante de corazón bajo una investigación clínica aprobado por la FDA. En Europa, el Jarvik 2000 obtuvo certificación la marca CE para el uso puente al trasplante y toda la vida. Actualmente se están desarrollando la versión infantil. |
| MicroMed DeBakey VAD | MicroMed | Flujo continuo impulsado por rotor axial apoyado por rodamientos cerámicos. | Aprobado para su uso en la Unión Europea. La versión del niño está aprobada por la FDA para uso en niños en Estados Unidos. Sometidos a ensayos clínicos en Estados Unidos para la aprobación de la FDA. |
| VentrAssist | Ventracor[43] | Flujo continuo impulsado por un rotor centrífugo hidrodinámico suspendido. | Aprobado para su uso en la Unión Europea y Australia. Compañía se declaró en bancarrota mientras que los ensayos clínicos para la aprobación de la FDA estaban en marcha en 2009. La compañía ahora disuelto y propiedad intelectual vendido a Thoratec. |
| MTIHeartLVAD | MiTiHeart Corporation | Flujo continuo impulsado por un rotor centrífugo magnéticamente suspendido. | Sin embargo para iniciar los ensayos clínicos. |
| C-pulso | Sunshine corazón | Pulsátil, impulsada por un manguito inflable alrededor de la aorta. | Actualmente en ensayos clínicos en los Estados Unidos y Australia. |
| HVAD | HeartWare | Miniatura "tercera generación" dispositivo con sendero de sangre centrífugo y rotor hydromagnetically falso que puede ser colocado en el espacio pericárdico. | Obtiene la marca CE para su distribución en Europa, enero de 2009. Obtuvo la aprobación del FDA en los Estados Unidos, noviembre de 2012. Inició nos BTT juicio en octubre de 2008 (finalizado en febrero de 2010) y nos DT prueba en agosto de 2010 (inscripción finalizado mayo de 2012). |
| MVAD | HeartWare | Bomba de MVAD de HeartWare es un dispositivo de asistencia ventricular en miniatura fase de desarrollo, aproximadamente un tercio del tamaño de la bomba de HeartWare HVAD. | HeartWare completado estudios de GLP (septiembre de 2011). |
| DuraHeart | Terumo | Bomba centrífuga de levitación magnética. | CE aprobado, los ensayos de la FDA de los E.e.u.u. en marcha en enero de 2010. |
| THORATEC PVAD (dispositivo de asistencia Ventricular Paracorporeal) | THORATEC | Pulsátil sistema incluye tres componentes principales: bomba, cánulas y conductor neumática (consola de impulsión dual o portable controlador VAD) de la sangre. | Autorizado de la marca CE. Recibida la aprobación del FDA para BTT en 1995 y para la recuperación post-cardiotomías (cirugía a corazón abierto) en 1998. |
| IVAD – dispositivo de asistencia Ventricular Implantable | THORATEC | Pulsátil sistema incluye tres componentes principales: bomba, cánulas y conductor neumática (consola de impulsión dual o portable controlador VAD) de la sangre. | Autorizado de la marca CE. Recibida la aprobación del FDA para BTT en 2004. Autorizado sólo para implantes internos, no para paracorporeal implante debido a problemas de fiabilidad. |
Véase también
- Balón intraaórtico de contrapulsación
- Gus Rosenberg
Referencias
- ^ a b Birks, J. E.; Tansley, P. D.; Hardy, J.; George, R. S.; Bowles, C. T.; Burke, M.; Banner, R. N.; Khaghani, A.; Yacoub, M. H. (2006). Dispositivo de asistencia Ventricular izquierda y el tratamiento farmacológico de la revocación de la insuficiencia cardíaca. New England Journal of Medicine 355 (18): 1873 – 1884. Doi:10.1056/NEJMoa053063. PMID17079761.
- ^ a b Primera recuperación VentrAssist corazón aparece en la televisión nacional. ventracor.com, 19 de octubre de 2006.
- ^ Osaki, Saturo; Edwards, Velez, Johnson, et al (agosto de 2008). "Mejoró la supervivencia en pacientes con terapia de dispositivo de asistencia ventricular: la experiencia de la Universidad de Wisconsin". Diario europeo de cirugía Cardio-torácica 34 (2): 281-288. Doi:10.1016/j.EJCTS.2008.04.023. PMID18513988.
- ^ Schulman, A. R.; Martens, T. P.; Christos, P. J.; Russo, J. M.; Comas, G. M.; Cheema, F. H.; Naseem, T. M.; Wang, R.; Idrissi, K. A.; Bailey, S. H.; Naka, Y. (2007). "Las comparaciones de las complicaciones de la infección entre el flujo continuo y flujo pulsátil ventricular izquierda ayudar a dispositivos". La revista de cirugía torácica y Cardiovascular 133 (3): 841 – 842. Doi:10.1016/j.jtcvs.2006.09.083. PMID17320612.
- ^ Slaughter, M. S.; Pagani, F. D.; Rogers, J. G.; Miller, W. L.; Sol, B.; Russell, S. D.; Estornino, R. C.; Chen, L.; Boyle, A. J.; Chillcott, S.; Adamson, R. M.; Sangre, M. S.; Camacho, M. T.; Idrissi, K. A.; Petty, M.; Sobieski, M.; Wright, S.; Myers, J. T.; Farrar, D. J.; Investigadores clínicos HeartMate II (2010). "Manejo clínico de flujo continuo ventricular izquierda asistir dispositivos en insuficiencia cardiaca avanzada". La revista del corazón y el trasplante de pulmón 29 (4): S1 – 39. Doi:10.1016/j.healun.2010.01.011. PMID20181499.
- ^ Fukamachi, Kiyo; Smedira, Nicholas (agosto de 2005). "Trasplantar más pequeño, más seguro, totalmente Implantable: realidad o fantasía?". American College of Cardiology actual Journal Review 14 (8): 40-42.
- ^ Frank Smart."Levitación magnética Bombeo cardíaco implantado en el primer paciente de Estados Unidos"."Cardiología hoy". Octubre de 2008.
- ^ Pai, C. N.; Shinshi, T.; Asama, J.; Takatani, S.; Shimokohbe, A. (2008). "Desarrollo de una bomba de sangre centrífugo compacto Maglev alojado en una carcasa de titanio". Revista de diseño mecánico avanzado y sistemas de fabricación 2 (3): 343. Doi:10.1299/jamdsm.2.343.
- ^ Largo, Geoff "Alta eficiencia, alta densidad Electromotores de alimentación", cafefoundation.org, muestra fotos de "bombas de sangre implantables maglev".
- ^ Hoshi, H.; Shinshi, T.; Takatani, S. (2006). "Sangre de tercera generación bombas con cojinetes magnéticos sin contacto mecánicos". Órganos artificiales 30 (5): 324 – 338. Doi:10.1111/j.1525-1594.2006.00222.x. PMID16683949.
- ^ Los niños de hoy, (19 de marzo de 1988). "Corazón bomba progreso anunciado - un paso prometedor en la tecnología de corazón artificial". Los niños de hoy (Marzo): 1,5.
- ^ "El primer paciente del uso de la vida". Corazón Jarvik. Retrieved 04 de agosto de 2009.
- ^ Paciente establece récord mundial para vivir con dispositivo de corazón. texasheart.org, 06 de julio de 2007.
- ^ Maugh, Thomas (14 de julio de 2009). "Trasplante demuestra capacidad reparadora del corazón". Los Angeles Times. 15 de septiembre de 2009.
- ^ Pagani, F. D.; Miller, W. L.; Russell, S. D.; Aaronson, K. D.; John, r.; Boyle, A. J.; Conte, J. V.; Bogaev, R. C.; MacGillivray, T. E.; Naka, Y.; Mancini, D.; Massey, H. T.; Chen, L.; Klodell, C. T.; Aranda, J. M.; Moazami, N.; Ewald, G. A.; Farrar, D. J.; Frazier, O. H.; Heartmate Ii, I. (2009). "Extendido soporte circulatorio mecánico con un dispositivo de asistencia Ventricular izquierda rotativo de flujo continuo". Revista de la American College of Cardiology 54 (4): 312-321. Doi:10.1016/j.JACC.2009.03.055. PMID19608028.
- ^ "Cirujanos cardíacos Heidelberg implante primer nuevo DeBakey corazón ayudar a dispositivo del mundo". Insciences. 17 de agosto de 2009. 15 de septiembre de 2009.
- ^ Quinn, Dale (04 de agosto de 2009). "Estudio VA: corazón-curación parche". Arizona Daily star. 15 de septiembre de 2009.
- ^ "Un estudio de Anginera en pacientes sometidos a la arteria coronaria (CABG) cirugía de Bypass". ClinicalTrials.gov (US National Institutes of Health). 27 de marzo de 2009. 15 de septiembre de 2009.
- ^ Hunter, Tim (13 de septiembre de 2009). "Conocer al hombre biónico Kiwi". Manawatu estándar. 15 de septiembre de 2009.
- ^ "Renovado Grant $ 2,8 millones para el desarrollo del corazón Artificial Total"Pulso-Less"". Houston: BusinessWire. 06 de agosto de 2009. 15 de septiembre de 2009.
- ^ "Evaluación del sistema de Davi HeartWare para el tratamiento de la insuficiencia cardíaca avanzada". Baltimore: Johns Hopkins Medical. Mayo de 2009. 15 de septiembre de 2009.
- ^ "HeartWare internacional supera 50 implantes en los Estados Unidos". Bio-Medicina. 20 de agosto de 2009. 15 de septiembre de 2009.
- ^ "Thoratec anuncia primer implante humano HeartMate III ™ y comienzo de juicio marca CE". 20 de agosto de 2009. 15 de septiembre de 2009.
- ^ Bogaev, Roberta; Chen, Russell, Rogers, et al (2007). "Una opción emergente para las mujeres con insuficiencia cardíaca avanzada: resultados del flujo continuo de HeartMate II dejaron Ventricular Assist dispositivo puente al trasplante de juicio". Aspectos médicos de fallo cardíaco en fase final: trasplante y terapias de dispositivo. II (Asociación Americana del corazón) 116:: 372.
- ^ Popov, A. F.; Hosseini, M. T.; Zych, B.; Simon, A. R.; Bahrami, T. (2012). "Asistencia Ventricular izquierda HeartWare dispositivo implantación a través de toracotomía Anterior Bilateral". Los anales de la cirugía torácica 93 (2): 674-676. Doi:10.1016/j.athoracsur.2011.09.055. PMID22269746.
- ^ Benton, Susan (19 de agosto de 2008). "Hoja del hecho ensayo clínico Pivotal HeartMate II". THORATEC Corporation. 10 de septiembre de 2009.
- ^ Dewey, Todd (19 de agosto de 2008). "El HeartMate II LVAS Pivotal Trial". Dallas: Cardiopulmonar investigación ciencia y tecnología del Instituto. Archivado de el original el 13 de julio de 2007. 10 de septiembre de 2009.
- ^ Mager, Belinda (25 de abril de 2008). "La FDA aprueba la bomba del corazón mecánico HeartMate II para pacientes con insuficiencia cardíaca a la espera de trasplante de órganos". New York Presbyterian Hospital Universitario. 13 de septiembre de 2009.
- ^ Miller, W. L.; Pagani, F. D.; Russell, S. D.; John, r.; Boyle, A. J.; Aaronson, K. D.; Conte, J. V.; Naka, Y.; Mancini, D.; Delgado, R. M.; MacGillivray, T. E.; Farrar, D. J.; Frazier, O. H.; Investigadores clínicos HeartMate II (2007). "Uso de un dispositivo de flujo continuo en los pacientes a la espera de trasplante de corazón". New England Journal of Medicine 357 (9): 885 – 896. Doi:10.1056/NEJMoa067758. PMID17761592.
- ^ Gavin, Kara (23 de abril de 2008). "Momentos emocionantes para dispositivos de corazón-asistencia en A-U-M". Ann Arbor: Universidad de Michigan. 28 de agosto de 2009.
- ^ "Thoratec HeartMate II LVAS – P060040". Ann Arbor. Food and Drug Administration. 23 de abril de 2008. 28 de agosto de 2009.
- ^ Eisen, H. J.; Hankins, S. R. (2009). "Dispositivo de asistencia Ventricular izquierda rotatorio de flujo continuo". Revista de la American College of Cardiology 54 (4): 322-324. Doi:10.1016/j.JACC.2009.04.028. PMID19608029.
- ^ Estornino, Randall; Naka, Boyle, Gonzalez-Stawinski, et al (agosto de 2009). "FDA inicial estudio posteriores a la homologación INTERMACS registro los resultados con un dispositivo de asistencia Ventricular izquierda de flujo continuo como puente al trasplante de corazón". Diario de insuficiencia cardíaca 15 (6): S46. Doi:10.1016/j.cardfail.2009.06.252.
- ^ Miller, Leslie; Aaronson y Pagani (2008). "Estudio de protocolo Harefield recuperación para pacientes con insuficiencia cardíaca crónica refractaria (arpas)". ClinicalTrials.gov. 2009-08-03.
- ^ Rose, A. E.; Moskowitz, A. J.; Packer, M.; Sollano, j.; Williams, D. L.; Tierney, A. R.; Heitjan, D. F.; Meier, P.; Ascheim, D. D.; Levitan, R. G.; Weinberg, D. c.; Stevenson, W. L.; Shapiro, A. P.; Lazar, R. M.; Watson, J. T.; Goldstein, J. D.; Gelijns, A. C. (1999). "El juicio de revancha: fundamentos, diseño y puntos finales. Evaluación aleatoria de asistencia mecánica para el tratamiento de la insuficiencia cardíaca congestiva". Los anales de la cirugía torácica 67 (3): 723 – 730. Doi:10.1016/S0003-4975 (99) 00042-9. PMID10215217.
- ^ Rogers, J. G.; Butler, J.; Lansman, S. L.; Gass, A.; Portner, P. M.; Pascua, M. K.; Pierson, R. N.; Intrépido, I. (2007). "Crónica soporte circulatorio mecánico para pacientes con insuficiencia cardíaca inotrópicos dependientes que son trasplante no candidatos". Revista de la American College of Cardiology 50 (8): 741-747. Doi:10.1016/j.JACC.2007.03.063. PMID17707178.
- ^ a b Schaffer, Justin M.; Arnaoutakis, George J.; Allen, Jeremiah G.; Weiss, Eric S.; Patel, Nishant D.; Russell, Stuart D.; Shah, Ashish S.; Conte, John V. "Complicaciones de sangrado y utilización de productos de sangre con la implantación del dispositivo de asistencia Ventricular izquierda". Los anales de la cirugía torácica 91 (3): 740 – 749. Doi:10.1016/j.athoracsur.2010.11.007.
- ^ a b c Goldstein, Daniel J.; Robert B. Beauford (2003). "Dejó a dispositivos de asistencia ventricular y sangrado: añadiendo insulto a la injuria". Ann Torac Surg 75:: S42 – 7. PMID12820734.
- ^ Spanier, Talia; Mehmet Oz; Howard Levin; Alan Weinberg; Kathy Stamatis; David Stern; Eric Rose; Anne Marie Schmidt (1996). "La activación de la coagulación y fibrinolíticas vías con ventricular izquierda ayudar a dispositivos". J Thorac Cardiovasc Surg 112:: 1090 – 1097. PMID8873737.
- ^ Samuels, L. E.; Kohout, J.; Casanova-Ghosh, E.; Hagan, K.; Garwood, P.; Ferdinand, f.; Goldman, M. S. (2008). "Argatroban como un anticoagulante postoperatorio primario o secundario en los pacientes implantados con dispositivos de asistencia Ventricular". Los anales de la cirugía torácica 85 (5): 1651-1655. Doi:10.1016/j.athoracsur.2008.01.100. PMID18442558.
- ^ Gordon RJ, Quagliarello B, Lowy FD (2006). "Infecciones relacionadas con el dispositivo de asistencia ventricular". Lancet infecta Dis 6 (7): 426 – 37. Doi:10.1016/S1473-3099 (06) 70522-9. PMID16790383.
- ^ Holman, W. L.; Rayburn, K. B.; McGiffin, D. C.; Foley, B. A.; BENZA, R. L.; Bourge, R. C.; Pinderski, J. L.; Kirklin, K. J. (2003). "La infección en ventricular assist dispositivos: prevención y tratamiento". Los anales de la cirugía torácica 75 (6 Suppl): S48-S57. Doi:10.1016/S0003-4975 (03) 00479-X. PMID12820735.
- ^ Ventracor fue puesta en liquidación de 03 de julio de 2009, por el que los activos de la compañía incluyendo su propiedad intelectual, datos de ensayos clínicos, planta y equipo y activos residuales se pondrá para la ventaBoyd, Tony (13 de julio de 2009). "Sin corazón". Espectador negocios. 15 de septiembre de 2009.
Enlaces externos
- Davi LifeFlow en la Universidad de Virginia
- Nader Moazami, Patrick M. McCarthy Soporte circulatorio temporal
- Eugene L. Kukuy, Mehmet C. Oz, Yoshifumi Naka Soporte circulatorio mecánico a largo plazo – una revisión del tema como en 2003.
- Centro de recursos de soporte circulatorio mecánico
- Centro de salud VAD en línea
- Mayo Clinic VAD
- Vida sin pulso — noticia de hombre canadiense con VAD
- Diseño de la bomba del corazón podría dar a los pacientes nueva esperanza — Una nueva bomba de contraflujo corazón desarrollado por Queensland University of Technology
- Bomba del corazón mejora la calidad de vida en pacientes con insuficiencia cardíaca congestiva Una revisión rápida de la opinión médica especialista y literatura como en diciembre de 2005
- INSTITUTO NACIONAL DE SALUD Y EXCELENCIA CLÍNICA (REINO UNIDO) Resumen de procedimientos intervencionistas – soporte circulatorio a corto plazo con ventricular izquierda ayudar a dispositivos como puente al trasplante cardiaco o recuperación Una revisión rápida de la opinión médica especialista y literatura como en diciembre de 2005
- Courtney J. Gemmato, Matthew D. Forrester, Timothy J. Myers,O.H. Frazier, A. Denton Cooley Treinta y cinco años de soporte circulatorio mecánico en el Texas Heart Institute Tex corazón Inst J 2005; 32:168-77
- MyLVAD.com No marca sitio con video, noticias y comunidad discusiones sobre de VAD.
- Dispositivo de asistencia ventricular (VAD) Centro para la insuficiencia cardíaca – Northwestern Memorial Hospital
- [1] Sitio web Facultad de medicina de Hannover. DAVI FAQ.
|
||||||||||||||||||||||||||||||||||||||