Cristalización
| Cristalización | |
|---|---|
 |
|
| Conceptos | |
| Cristalización· Crecimiento de cristales Recristalización· Cristal de semilla Protocrystalline· Solo cristal |
|
| Fundamentos | |
| Nucleación· Cristal Estructura cristalina· Sólido |
|
| Métodos y tecnología | |
| Troncos aserrados y reconstruidos· Bridgman-Stockbarger Proceso de Czochralski Frac. crystalliz.· Frac. congelación Hydroth. síntesis· LHPG· Proceso de yoduro |
|
Cristalización es el proceso (natural o artificial) de la formación de sólidos cristales precipitación desde un solución, fusión o más raramente depositado directamente en un gas. Cristalización es también una técnica de separación sólido – líquido químico, en el que masa la transferencia de un soluto de la solución líquida a una fase cristalina sólida pura ocurre. En ingeniería química cristalización se produce en un cristalizador. Cristalización es, por tanto, un aspecto de precipitación, obtenida a través de una variación de la solubilidad condiciones de la soluto En solvente, en comparación con la precipitación debido a la reacción química.
Contenido
- 1 Proceso
- 2 Cristalización en la naturaleza
- 3 Métodos artificiales
- 3.1 Producción de cristal
- 3.2 Purificación del
- 3.3 Equipo típico
- 4 Vista termodinámico
- 5 Dinámica de cristalización
- 5.1 Nucleación
- 5.1.1 Nucleación primaria
- 5.1.2 Nucleación secundaria
- 5.2 Crecimiento de cristales
- 5.3 Distribución de tamaño de cristal
- 5.1 Nucleación
- 6 Procesos de cristalización principal
- 6.1 Cristalización de enfriamiento
- 6.1.1 Aplicación
- 6.1.2 Cristalizadores de enfriamiento
- 6.2 Cristalización por evaporación
- 6.2.1 Cristalizadores por evaporación
- 6.3 Cristalizador DTB
- 6.1 Cristalización de enfriamiento
- 7 Véase también
- 8 Referencias
- 9 Lectura adicional
- 10 Enlaces externos
Proceso
 Reproducir archivos multimedia
Reproducir archivos multimedia
- Véase también dinámica de cristalización sección.
El proceso de cristalización consta de dos grandes eventos, nucleación y crecimiento de cristales. Nucleación es el paso donde las moléculas de soluto se dispersan en la solvente empezar a recolectar en racimos, en la nanómetro escala (elevando la concentración de solutos en una región pequeña), que se convierten en estables bajo las condiciones actuales de operación. Estos racimos estables constituyen los núcleos. Sin embargo, cuando los grupos no son estables, se disuelven. Por lo tanto, los grupos necesitan alcanzar un tamaño crítico para convertirse en núcleos estables. Tal tamaño crítico es dictado por el servicio (las condicionestemperatura, sobresaturaciónetc..). Es en la etapa de nucleación que los átomos se arreglan en una definida y periódico manera que define el estructura cristalina — Tenga en cuenta que la "estructura cristalina" es un término especial que se refiere a la disposición relativa de los átomos, no las propiedades macroscópicas del cristal (tamaño y forma), aunque aquellos son el resultado de la estructura cristalina interna.
El crecimiento de cristales es el crecimiento subsecuente de los núcleos que tienen éxito en alcanzar el tamaño crítico del racimo. Nucleación y crecimiento continúan ocurren simultáneamente mientras la sobresaturación. La sobresaturación es la fuerza impulsora de la cristalización, por lo tanto, la tasa de nucleación y crecimiento está impulsada por la sobresaturación existente en la solución. Dependiendo de las condiciones, nucleation o el crecimiento puede ser predominante sobre la otra, y como resultado, se obtienen cristales de diferentes tamaños y formas (control de forma y tamaño de cristal constituye uno de los principales retos de industrial de fabricación, tales como productos farmacéuticos). Una vez que la sobresaturación se agota, el sistema sólido – líquido alcanza el equilibrio y la cristalización es completa, a menos que se modifican las condiciones de funcionamiento del equilibrio para supersaturate la solución otra vez.
Muchos compuestos tienen la capacidad de cristalizar con las estructuras cristalinas diferentes, un fenómeno llamado polimorfismo de la. Cada polimorfo es en realidad un estado sólido termodinámico diferente y polimorfos cristalinos del mismo compuesto exhiben diferentes propiedades físicas, tales como la velocidad de disolución, forma (ángulos entre las facetas y las tasas de crecimiento de la faceta), punto de fusión, etc.. Por esta razón, el polimorfismo es de gran importancia en la fabricación industrial de productos cristalinos.
Cristalización en la naturaleza


Hay muchos ejemplos de procesos naturales que involucran la cristalización.
Escala de tiempo geológico ejemplos de proceso incluyen:
- Formación natural cristalina (mineral) (véase también piedras preciosas);
- Estalactita/estalagmita, anillos de formación.
Ejemplos de proceso de escala de tiempo generalmente incluyen:
- Copos de nieve formación;
- Miel cristalización (casi todos los tipos de miel se cristalizan).
Métodos artificiales

Para la cristalización (véase también recristalización) de una solución debe ser sobresaturado. Esto significa que la solución tiene que contener más entidades de soluto (moléculas o iones) disuelto que contendría en el equilibrio (solución saturada). Esto puede lograrse por varios métodos, con (1) solución de enfriamiento, (2) adición de un segundo solvente para reducir la solubilidad del soluto (técnica conocida como antisolvent o se ahogan), reacción química (3) y (4) cambio en el pH, siendo los métodos más comunes utilizados en la práctica industrial. También pueden utilizar otros métodos, tales como evaporación de disolventes. La cristalización esférica tiene algunas ventajas (fluidez y biodisponibilidad) para la formulación de fármacos (ver ref Nocent & al., 2001)[1]
Producción de cristal
Desde un industria del material de perspectiva:
- Cristal macroscópico producción: para abastecer la demanda de cristales naturales con métodos que "aceleran la escala de tiempo" para la producción masiva o perfección.
- Jónico cristal producción;
- Covalente cristal producción.
- Cristal de tamaño reducidos:
- Polvo, arena y tamaños más pequeños:: métodos para el polvo y controlado (nanotecnología frutas) formas.
- Producción en masa:: en industria química, como producción de polvo de sal.
- Producción de la muestra:: pequeña producción de diminutos cristales de caracterización de materiales. Recristalización controlada es un método importante para suministrar cristales inusuales, que son necesarios para revelar la estructura molecular y las fuerzas nucleares dentro de una molécula típica de un cristal. Muchas técnicas, como Cristalografía de rayos x y Espectroscopia de RMN, son ampliamente utilizados en química y bioquímica para determinar las estructuras de una inmensa variedad de moléculas, incluyendo compuestos inorgánicos y Bio-macromoléculas.
- Película fina producción.
- Polvo, arena y tamaños más pequeños:: métodos para el polvo y controlado (nanotecnología frutas) formas.
Purificación del
Utilizado para mejorar (la obtención de sustancias muy puras) o verificar su pureza.
Cristalización separa un producto de un feedstream líquido, a menudo en forma muy pura, por la feedstream de refrigeración o añadir precipitados que baje la solubilidad del producto deseado de modo que forma cristales.
Cristales bien formados deben ser puros porque cada molécula o ion debe encajan perfectamente en el entramado ya que deja la solución. Las impurezas normalmente no caben también en el enrejado y así permanecen en solución preferencial. Por lo tanto, el reconocimiento molecular es el principio de purificación en cristalización. Sin embargo, hay casos cuando las impurezas incorporan en el enrejado, por lo tanto, disminuyendo el nivel de pureza del producto final cristal. También, en algunos casos, el solvente puede incorporar en la formación del enrejado una solvato. Además, el solvente puede ser 'atrapado' (en estado líquido) en el cristal formado, y este fenómeno se conoce como "inclusión".
Equipo típico
Equipo para la principales procesos industriales de cristalización.
- Cristalizadores de tanque. Cristalización del tanque es un viejo método todavía utilizado en algunos casos especializados. Soluciones saturadas, en la cristalización del tanque, se deja enfriar en tanques abiertos. Después de un período de tiempo que el licor madre se drena y los cristales. Nucleación y tamaño de los cristales son difíciles de controlar. Por lo general, los costos laborales son muy altos.
Vista termodinámico

La naturaleza de un proceso de cristalización se rige por factores termodinámicos y cinéticos, que pueden hacer altamente variable y difícil de controlar. Factores como el nivel de impureza, régimen, diseño de la embarcación, de mezcla y enfriamiento perfil pueden tener un impacto importante sobre el tamaño, número y forma de cristales producidos.
Ahora ponte en el lugar de una molécula dentro de un puro y cristal perfecto, siendo calentada por una fuente externa. A cierta temperatura agudamente definido, la complicada arquitectura del cristal se derrumba a la de un líquido. Libros de texto termodinámica dice que la fusión ocurre porque el entropía, S, aumento en su sistema de aleatorización espacial de las moléculas ha superado la Entalpia de, H, pérdida por romper el cristal de las fuerzas del embalaje:

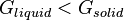
Esta regla no sufre excepciones cuando la temperatura está en aumento. De la misma manera, en el enfriamiento de la fusión, a la misma temperatura la campana debe sonar otra vez, y moléculas deben hacer clic en la misma forma cristalina. La disminución de la entropía debido a la ordenación de las moléculas dentro del sistema es overcompensated por el randomization termal de los alrededores, debido a la liberación de calor de fusión; la entropía del universo aumenta.
Pero los líquidos que se comportan de esta manera el enfriamiento son más la excepción que la regla; a pesar de la segundo principio de la termodinámica, cristalización ocurre generalmente en temperaturas más bajas (subenfriamiento). Esto sólo puede significar que un cristal se destruye más fácilmente que está formado. Semejantemente, es generalmente mucho más fácil disolver un cristal perfecto en un disolvente que al crecer de nuevo un buen cristal de la solución resultante. La nucleación y el crecimiento de un cristal están bajo control cinético, en lugar de termodinámica.
Dinámica de cristalización
Como se mencionó anteriormente, un cristal se forma siguiendo un patrón bien definido, o estructura, dictada por las fuerzas que actúan a nivel molecular. Como consecuencia, durante su proceso de formación de la cristal se encuentra en un entorno donde el soluto concentración alcanza un cierto valor crítico, antes de cambiar de estado. Sólido formación, imposible por debajo de la solubilidad umbral en el dado temperatura y presión condiciones, entonces puede tener lugar en una concentración más alta que el nivel de solubilidad teórica. La diferencia entre el valor real de la concentración del solute en el límite de cristalización y el umbral teórico solubilidad (estática) se llama sobresaturación y es un factor fundamental en la dinámica de la cristalización. La sobresaturación es la fuerza impulsora para el paso inicial de la nucleación y el crecimiento cristalino siguientes, que no podrían ocurrir en condiciones saturadas o infrasaturadas.
Nucleación
Nucleación es la iniciación de un cambio de fase en una región pequeña, como la formación de un cristal sólido de un líquido. Es una consecuencia de las fluctuaciones locales rápidas a escala molecular en una fase homogénea que se encuentra en un estado de equilibrio metastable. Nucleación total es el efecto de la suma de las dos categorías de nucleación – primaria y secundaria.
Nucleación primaria
Nucleación primaria es la formación inicial de un cristal donde hay no otros cristales o donde, si hay cristales presentes en el sistema, no tienen ninguna influencia en el proceso. Esto puede ocurrir en dos condiciones. La primera es nucleación homogénea, nucleación que no está influenciado de alguna manera por sólidos. Estos sólidos son las paredes del vaso cristalizador y partículas de cualquier sustancia extraña. La segunda categoría, entonces, es la nucleación heterogénea. Esto ocurre cuando las partículas sólidas de substancias causan un aumento en la tasa de nucleación que de lo contrario no se verían sin la existencia de estas partículas. Nucleación homogénea ocurre raramente en la práctica debido a la alta energía necesaria para iniciar la nucleación sin una superficie sólida para catalizar la nucleación.
Nucleación primaria (homogénea y heterogénea) ha sido modelado con la siguiente:[1]
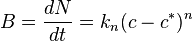
- B es el número de núcleos formados por unidad de volumen por unidad de tiempo.
- N es el número de núcleos por unidad de volumen.
- kn es una constante de velocidad.
- c es la concentración instantánea de solutos.
- c* es la concentración del soluto en saturación.
- (c – c*) también es conocido como sobresaturación.
- n es un exponente empírico que puede ser tan grande como 10, pero generalmente oscila entre 3 y 4.
Nucleación secundaria
Nucleación secundaria es la formación de núcleos atribuibles a la influencia de los cristales microscópicos existentes en el magma.[2] El primer tipo de cristalización secundaria conocido es atribuible a esquileo líquido, el otro debido a las colisiones entre ya cristales existentes ya sea una superficie sólida de la cristalizador o con otros cristales ellos mismos. Nucleación de esquileo líquido ocurre cuando líquido viaja a través de un cristal a una alta velocidad, eliminando los núcleos que de lo contrario se incorporaría en un cristal, haciendo que los núcleos barrió lejos a convertirse en nuevos cristales. Nucleación de contacto se ha encontrado para ser el método más efectivo y común para la nucleación. Los beneficios incluyen lo siguiente [2]
- Orden cinético y tasa proporcional a sobresaturación, permitiendo el fácil control sin operación inestable.
- Se produce en sobresaturación baja, donde la tasa de crecimiento es óptimo para la buena calidad.
- Baja energía necesaria en la que huelga cristales evita la rotura de cristales existentes en nuevos cristales.
- Los fundamentos cuantitativos ya se han aislado y se están incorporando a la práctica.
El modelo siguiente, aunque algo simplificada, a menudo se utiliza para modelar la nucleación secundaria:[1]

- k1 es una constante de velocidad.
- MT es la densidad de la suspensión.
- j es un exponente empírico que puede extenderse hasta 1.5, pero es generalmente 1.
- b es un exponente empírico que puede variar hasta 5, pero generalmente es 2.
Crecimiento de cristales
Crecimiento de cristales
Una vez que el primer cristal pequeño, el núcleo lo forma actúa como un punto de convergencia (si es inestable debido a la sobresaturación) para moléculas de de soluto tocando – o junto a – el cristal por lo que ello aumenta su propia dimensión en capas sucesivas. El patrón de crecimiento se asemeja a los anillos de una cebolla, como se muestra en la imagen, donde cada color indica que la misma masa de soluto; Esta masa crea capas cada vez más finas debido al área superficial creciente del cristal creciente. El núcleo original de la masa de soluto sobresaturada puede captura de en un momento se llama unidad del tasa de crecimiento expresado en kg / (m2* h), y es una constante específica para el proceso. Tasa de crecimiento está influenciado por varios factores físicos, tales como tensión superficial de solución, presión, temperatura, cristal relativa velocidad en la solución, Número de Reynolds, y así sucesivamente.
Los valores principales de control son por lo tanto:
- Valor de sobresaturación, como un índice de la cantidad de soluto disponible para el crecimiento del cristal;
- Superficie de cristal total en la unidad de masa de fluido, como un índice de la capacidad del soluto para fijar sobre el cristal;
- Tiempo de retención, como un índice de probabilidad de una molécula de soluto entre en contacto con un cristal existente;
- Caudal patrón, otra vez como un índice de probabilidad de una molécula de soluto entre en contacto con un cristal existente (superior en cabina de flujo laminar, inferior en flujo turbulentopero la inversa se aplica a la probabilidad de contacto).
El primer valor es una consecuencia de las características físicas de la solución, mientras que otros definen la diferencia entre un bien y un cristalizador mal diseñado.
Distribución de tamaño de cristal
La gama de tamaño y aspecto de un producto cristalino es extremadamente importante en cristalización. Si se desea proseguir la elaboración de los cristales, cristales grandes con tamaño uniforme son importantes para el lavado, filtración, transporte y almacenamiento. La importancia radica en el hecho de que los cristales grandes son más fáciles de filtrar de una solución de pequeños cristales. También, cristales más grandes tienen un área superficial más pequeño al cociente del volumen, conduce a una mayor pureza. Esta mayor pureza es debido a la menor retención de licor de madre que contiene impurezas y una menor pérdida de rendimiento cuando los cristales se lavan para eliminar el licor de madre. La distribución de tamaño de cristal teórico puede estimarse en función de las condiciones de operación con un proceso matemático bastante complicado llamado teoría de equilibrio de la población (usando ecuaciones de balance de población).
Procesos de cristalización principal
Los principales factores que influyen en la solubilidad son, como vimos arriba:
- Concentración
- Temperatura
Por lo tanto podemos identificar dos principales familias de procesos de cristalización:
- Cristalización de enfriamiento
- Cristalización por evaporación
Esta división no es muy clara, puesto que existen sistemas híbridos, donde el enfriamiento se realiza a través evaporación, obteniendo al mismo tiempo una concentración de la solución.
Un proceso de cristalización a menudo mencionados en ingeniería química es el cristalización fraccionada. Esto no es un proceso diferente, más bien una aplicación especial de uno (o ambos) de los anteriores.
Cristalización de enfriamiento
Aplicación
La mayor parte compuestos químicos, disuelto en la mayoría de los solventes, mostrar el supuesto directa solubilidad es decir, aumenta el umbral de solubilidad con la temperatura.

Por lo tanto, siempre que las condiciones son favorables, la formación cristalina resulta de simplemente la solución de enfriamiento. Aquí refrigeración es un término relativo: austenita cristales en forma de acero muy por encima de 1000 ° C. Un ejemplo de este proceso de cristalización es la producción de Sal de Glauber, una forma cristalina de sulfato de sodio. En el diagrama, donde la temperatura de equilibrio está en el eje x y equilibrio concentración (% masa de soluto en solución saturada) en eje y, está claro que la solubilidad de sulfato disminuye rápidamente por debajo de 32,5 ° C. Suponiendo que una solución saturada a 30 ° C, por enfriamiento a 0 ° C (nota que esto es posible gracias a la depresión del congelar-punto), la precipitación de una masa de sulfato se produce correspondiente al cambio en la solubilidad del 29% (valor de equilibrio a 30 ° C) a aproximadamente 4.5% (a 0 ° C) – en realidad un cristal mayor masa se precipita, ya que arrastra el sulfato hidratación agua y esto tiene el efecto secundario de aumento de la concentración final.
Por supuesto hay limitación en el uso de refrigeración de cristalización:
- Muchos solutos precipitan en forma de hidrato a bajas temperaturas: en el ejemplo anterior es aceptable y hasta útil, pero puede ser perjudicial cuando, por ejemplo, la masa de agua de hidratación para llegar a una forma de cristalización de hidrato estable es más que el agua disponible: se formará un bloque de hidrato de soluto, esto ocurre en el caso de cloruro de calcio);
- Máxima sobresaturación llevará a cabo en los puntos más fríos. Estos pueden ser los tubos de intercambiador de calor que son sensibles a la escala, y intercambio de calor puede ser enormemente reducida o descontinuada;
- Una disminución en la temperatura generalmente implica un aumento de la viscosidad de una solución. Una viscosidad demasiado alta puede dar problemas de hidráulicas y la cabina de flujo laminar Así creó mayo afectan la dinámica de la cristalización.
- Por supuesto no es aplicable a compuestos con inversa solubilidad, un término para indicar la solubilidad aumenta con la disminución de la temperatura (un ejemplo ocurre con el sulfato de sodio donde se invierte la solubilidad superior a 32,5 ° C).
Cristalizadores de enfriamiento

Los cristalizadores de enfriamiento más simples son los tanques provistos de un mezclador para circulación interna, donde la disminución de temperatura se obtiene por intercambio de calor con un líquido intermedio circula en una chaqueta. Estas máquinas simples se utilizan en procesos por lotes, como en procesamiento de productos farmacéuticos y propensas a descamación. Procesos por lotes normalmente proporcionan una calidad relativamente variable del producto a lo largo del lote.
El Swenson-Walker cristalizador, es un modelo específicamente concebido por Swenson Co. alrededor de 1920, tener un canal hueco horizontal semicylindric en el que un hueco tornillo transportador o algunos discos huecos, en el que circula un fluido refrigerante, sumergen durante la rotación sobre un eje longitudinal. El refrigerante líquido a veces también se distribuye en una chaqueta alrededor del canal. Cristales se precipitan sobre las superficies frías de tornillo/discos, desde el que se eliminan mediante rasquetas y asentarse en el fondo del canal. El tornillo, si, empuja la mezcla hacia un puerto de descarga.
Una práctica común es enfriar las soluciones por evaporación de destello: cuando un líquido a una T dada0 temperatura se transfiere en una cámara a una presión P1 tal que la temperatura de saturación del líquido T1 en el P1 es menor que T0, liberará el líquido calor según la diferencia de temperatura y cantidad de solvente, cuyo total calor latente de vaporización es igual a la diferencia de Entalpia de. En palabras simples, el líquido se enfría por evaporación de una parte de ella.
El azúcar industria refrigeración cristalizadores vertical se utilizan para agotar el melaza en la última cristalización etapa aguas abajo de cacerolas del vacío, antes de centrifugar. La masa cocida entra en los cristalizadores en la parte superior, y agua de enfriamiento se bombea a través de tubos en contracorriente.
Cristalización por evaporación
Otra opción es obtener, a una temperatura aproximadamente constante, la precipitación de los cristales mediante el aumento de la concentración de solutos por encima del umbral de solubilidad. Para obtener esto, la relación entre masa de soluto/solvente se incrementa mediante la técnica de evaporación. Este proceso es insensible a cambios de temperatura (como estado de hidratación se mantiene sin cambios).
Todas las consideraciones sobre el control de parámetros de cristalización son los mismos que los modelos de enfriamiento.
Cristalizadores por evaporación
Cristalizadores industriales son del tipo evaporativo, tales como la gran cloruro de sodio y sacarosa unidades, cuya producción representa más del 50% de la producción mundial total de cristales. El tipo más común es la circulación forzada Modelo (FC) (véase evaporador de). Un dispositivo de bombeo (un bomba o un flujo axial mezclador) mantiene el cristal mezcla de homogénea suspensión a lo largo del tanque, incluyendo las superficies de intercambio; mediante el control de la bomba flujo, el control del tiempo de contacto de la masa de cristal con la solución sobresaturada es alcanzado, junto a velocidades razonables en las superficies de intercambio. El Oslo, mencionado anteriormente, es un refinamiento del cristalizador de evaporación de circulación forzada, ahora equipado con un grandes cristales asentamiento zona para aumentar el tiempo de retención (generalmente bajo en la FC) y aproximadamente separar zonas pesadas de la mezcla de líquido claro.
Cristalizador DTB


Cualquiera que sea la forma de cristalizador, para lograr un control de proceso efectivo es importante controlar el tiempo de retención y la masa de cristal, para obtener las condiciones óptimas en términos de superficie específica de cristal y el mayor crecimiento posible. Esto se logra una separación – poner simplemente – de los cristales de la masa líquida, con el fin de gestionar los dos flujos de una manera diferente. La forma práctica es realizar una gravedad colocar para poder extraer (y posiblemente reciclar por separado) el líquido claro (casi), al mismo tiempo, el flujo de masa en el cristalizador para obtener una densidad de la mezcla precisa en otra parte. Un ejemplo típico es la () DTBProyecto tubo y deflector) el cristalizador, una idea de Richard Bennett Chisum (Swenson ingeniero y más tarde presidente de Swenson) a finales de la década de 1950. El cristalizador DTB (ver imágenes) tiene un circulador interno, típicamente un mezclador de flujo axial – amarillo – empujando hacia arriba en un tubo de proyecto mientras que fuera del cristalizador hay una zona de sedimentación en un anillo; en él la solución de escape se mueve hacia arriba a una velocidad muy baja, para que grandes cristales resolver – y volver a la circulación principal – mientras solo las multas, debajo de un determinado grano tamaño son extraídos y eventualmente destruido por aumento o disminución de temperatura, creando así el adicional de la sobresaturación. Se logra un control casi perfecto de todos los parámetros. Este cristalizador y los modelos derivados (Krystal, CSC, etc.) podrían ser la solución definitiva si no por una limitación importante en la capacidad de evaporación, debido al limitado diámetro de la cabeza de vapor y la circulación externa relativamente baja no permite grandes cantidades de energía para suministrar al sistema.
Véase también
- Crecimiento de grano anormal
- Resolución quiral por cristalización
- Cristal
- Hábito cristalino
- Estructura cristalina
- Cristalito
- Crecimiento de cristales
- Cristalización fraccionada (química)
- Diferenciación ígnea
- Crecimiento de pedestal de láser calentada
- Micro-tira-abajo
- Tecnología de hielo bombeables
- Quasicrystal
- Recristalización (química)
- Recristalización (metalurgia)
- Cristal de semilla
- Solo cristal
- Symplectite
- Vitrificación
- Cristalografía de rayos x
Referencias
- ^ a b c Tavare, N.S. (1995). Cristalización industrial Plenum Press, Nueva York
- ^ a b McCabe y Smith (2000). Operaciones unitarias de ingeniería química ' McGraw-Hill, Nueva York
Lectura adicional
- A. Mersmann, Manual de tecnología de cristalización CRC (2001); 2 º Ed. ISBN 0-8247-0528-9
- Tine Arkenbout de Vroome, Tecnología de cristalización del derretimiento CRC (1995) ISBN 1-56676-181-6
- "Cristalización de moléculas pequeñas" (PDF) en el Illinois Institute of Technology sitio web
- Glynn P.D. y Reardon E.J. (1990) "equilibrios en solución acuosa solución sólida: teoría de la termodinámica y la representación". Amer. J. SCI. 290, 164-201.
- Geankoplis, C.J. (2003) "procesos de transporte y principios de procesos de separación". 4ª ed. Prentice-Hall Inc.
Enlaces externos
- Cristalización de lote
- Cristalización industrial
- Video Time-lapse con la cristalización de sales
|
||||||||||||||||||||||
|
||||||||||||||||||||
