K-caseína
K-caseína (o Kappa-caseína, caseína k, caseína kappa) es un mamíferos leche proteína implicado en un número de procesos fisiológicos importantes. En Gut, la proteína ingerida se divide en un insoluble péptido (para kappa-caseína) y un glicopéptido hidrofílico soluble (caseinomacropeptide). Caseinomacropeptide es responsable del aumento de la eficiencia de la digestión, prevención de la hipersensibilidad de recién nacido a las proteínas ingeridas y la inhibición del patógeno gástrico.[1]
Contenido
- 1 Estructura
- 2 La coagulación de la leche
- 3 Análisis de la FTC-K-caseína
- 4 Notas de la
- 5 Referencias
- 6 Enlaces externos
Estructura

Caseínas son una familia de fosfoproteínas (ΑS1, αS2, β, κ) representan casi el 80% de las proteínas de la leche bovina[3] y que forman agregados solubles conocidas como "micelas de caseína" en que κ-caseína moléculas estabilizan la estructura. Hay varios modelos que representan la conformación especial de la caseína en las micelas.[4] Uno de ellos propone que el núcleo micelar está formado por varios submicelles, la periferia de microvellosities de la κ-caseína[5][6] Otro modelo sugiere que el núcleo está formado por fibrillas interconectadas de caseína.[7] Por último, el modelo más reciente[8] propone un enlace doble entre las caseínas de gelificación para tomar lugar. 3 todos los modelos consideran partículas coloidales formadas por agregados de caseína envueltos en moléculas solubles de la κ-caseína micelas. Proteasas de la coagulación de la leche actúan sobre la porción soluble, κ-caseína, originando así un estado micelar inestable que resulta en la formación de coágulos.[9]
La coagulación de la leche

Quimosina (EC 3.4.23.4) es un aspártico proteasa que específicamente hidroliza el el peptide en Phe105-Met106 de la κ-caseína y se considera ser el protease más eficiente para la fabricación de queso industria.[10] Sin embargo, son capaces de allegarse otros enlaces peptídicos en la cadena κ-caseína, como la endothiapepsin producida por la coagulación de la leche proteasas Endothia parasitica.[11] También hay varias proteasas de la coagulación de la leche que, siendo capaz de hender el enlace Phe105-Met106 de la molécula de la κ-caseína, hienden también otros enlaces del peptide en otras caseínas, tales como los producidos por Cynara cardunculus[6][12][13] o quimosina bovina incluso.[14] Esto permite la fabricación de diversos quesos con una variedad de reológicas y propiedades organolépticas.
El proceso de coagulación de la leche consiste en 3 fases principales:[15]
- Degradación enzimática de la κ-caseína
- Micelar floculación
- Formación de gel
Cada paso sigue a otro cinético patrón, el paso limitante en la coagulación de la leche siendo la tasa de degradación de la κ-caseína. El patrón cinético de la segunda etapa del proceso de coagulación de la leche está influenciado por la naturaleza cooperativa de la floculación micelar,[16][13] Considerando que la reológicas propiedades del gel formado dependen del tipo de acción de las proteasas, el tipo de leche y los patrones de la proteólisis de la caseína.[13] El proceso global está influenciado por varios factores diferentes, tales como pH o temperatura.[12][9]
La forma convencional de cuantificar un determinado enzima de coagulación de la leche[17] emplea la leche como el substrato y determina que el tiempo transcurrido antes de la aparición de coágulos de leche. Sin embargo, la coagulación de la leche puede tener lugar sin la participación de enzimas debido a variaciones en factores fisicoquímicos como pH bajo o de alta temperatura.[6][3][9] En consecuencia, esto puede llevar a resultados confusos e irreproducible, especialmente cuando las enzimas tienen baja actividad. Al mismo tiempo, el método clásico no es suficiente, específico en términos de establecer el inicio preciso de la gelificación de la leche, que la determinación de las unidades enzimáticas implicadas se vuelve difícil y confusa. Además, aunque ha divulgado que eso hidrólisis de la κ-caseína sigue típico Michaelis-Menten cinética,[15] es difícil determinar con el clásico ensayo de coagulación de la leche.
Para superar esto, se han propuesto varios métodos alternativos, tales como la determinación del diámetro del halo en gelified agar leche,[17] medición colorimétrica,[18] o determinación de la tasa de degradación de la caseína etiquetada previamente ya sea con un trazador radioactivo[19] o un fluorocromo compuesto.[20] Todos estos métodos utilizan la caseína como sustrato para cuantificar proteolítica o actividades de la coagulación de la leche.
Análisis de la FTC-K-caseína
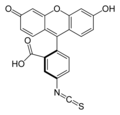
K-caseína etiquetada con el fluorocromo isotiocianato de fluoresceína (FITC) para producir () thiocarbamoyl del fluoresceinFTC) derivado. Este sustrato es utilizado para deternimate la actividad de las proteasas de la coagulación de la leche.[21]
Método de la FTC-κ-caseína proporciona determinaciones certeras y precisas de degradación κ-caseinolytic, el primer paso en el proceso de coagulación de la leche. Este método es el resultado de una modificación a la descrita por S.S. Twining (1984). La principal modificación fue sustituir el sustrato utilizado anteriormente (caseína) por - caseína etiquetada con el fluorocromo isotiocianato de fluoresceína (FITC) para rendir el derivado de fluoresceína thiocarbamoyl (FTC). Esta variación permite la cuantificación de las - moléculas de caseína degradadas de manera más precisa y específica, detectando solamente ésos enzimas capaces de degradar estas moléculas. El método descrito por Twining (1984), sin embargo, fue diseñado para detectar la actividad proteolítica de una variedad considerablemente grande de enzimas. FTC-κ-caseína permite la detección de diferentes tipos de proteasas en los niveles cuando no coagulación de la leche es todavía evidente, desvelando su mayor sensibilidad sobre actualmente utiliza procedimientos de ensayo. Por lo tanto, el método puede encontrar aplicación como indicador durante la purificación o la caracterización de nuevas enzimas de coagulación de la leche.
Notas de la
- ^ https://www.EBI.AC.uk/Interpro/DisplayIproEntry?AC=IPR000117[completa citación necesitó]
- ^ a b Kumosinski, Brown & Farrell 1993.
- ^ a b Lucena, Johnson & Horne 2003.
- ^ Dalgleish 1998.
- ^ Walstra 1979.
- ^ a b c Lucena 2002.
- ^ Holt 1992.
- ^ Horne 1998.
- ^ a b c Vasbinder et al., 2003.
- ^ Rao et al., 1998.
- ^ Drøhse & Foltmann 1989.
- ^ a b Esteves et al., 2003.
- ^ a b c Silva y Malcata 2005.
- ^ Kobayashi 2004.
- ^ a b Carlson, Hill & Olson 1987a.
- ^ Carlson, Hill & Olson 1987b.
- ^ a b Poza et al., 2003.
- ^ Casco de 1947.
- ^ Christen 1987.
- ^ Hermanamiento 1984.
- ^ Ageitos et al., 2006.
Referencias
- Ageitos, J.M.; Vallejo, J.A.; Poza, m..; Villa, T.G. (2006). "Ensayo de Thiocarbamoyl-Kappa-caseína de fluoresceína para la prueba específica de proteasas de la coagulación de la leche". Revista de Ciencias de la leche 89 (10): 3770-7. doi:10.3168/jds. S0022-0302 (06) 72418-3. PMID16960051.
- Carlson, Alfred; Hill, Charles G; Olson, Norman F. (1987). "Cinética de la coagulación de la leche: I. la cinética de la hidrólisis de la caseína kappa en presencia de desactivación de la enzima". Biotecnología y bioingeniería 29 (5): 582 – 9. doi:10.1002/bit.260290507. PMID18576489.
- Carlson, Alfred; Hill, Charles G.; Olson, Norman F. (1987). "Cinética de la coagulación de la leche: II. Cinética de la fase secundaria: floculación micela ". Biotecnología y bioingeniería 29 (5): 590-600. doi:10.1002/bit.260290508. PMID18576490.
- Christen, G.L. (1987). "Un método rápido para medir la actividad de las proteasas en la leche usando caseína radiactiva". Revista de Ciencias de la leche 70 (9): 1807-14. doi:10.3168/jds. S0022-0302 (87) 80218-7. PMID3117854.
- Dalgleish, D.G. (1998). "Micelas de caseína como coloides: estructuras y estabilidades de superficie". Revista de Ciencias de la leche 81 (11): 3013 – 8. doi:10.3168/jds. S0022-0302 (98) 75865-5.
- Drøhse, Helle B.; Foltmann, doblado (1989). "Especificidad de las enzimas de la coagulación de la leche hacia la κ-caseína bovina". Biochimica et Acta Scandinavica 995 (3): 221 – 4. doi:10.1016/0167-4838 (89) 90039-3. PMID2495817.
- Esteves, C.L.C.; Lucena, J.A.; Wang, T.; Pires, E.M.V. (2003). "Efecto del pH sobre la gelificación propiedades de leche descremada geles hechos de plantas coagulantes y quimosina". Revista de Ciencias de la leche 86 (8): 2558 – 67. doi:10.3168/jds. S0022-0302 (03) 73850-8. PMID12939079.
- Holt, C. (1992). Estructura y estabilidad de las micelas de caseína bovina. En Anfinsen, C.B.; Richards, Frederic M.; Edsall, John T. et al. Avances en química de proteína volumen 43. Avances en química de proteínas 43. págs. 63 – 151. doi:10.1016/S0065-3233 (08) 60554-9. ISBN978-0-12-034243-3. PMID1442324.
- Horne, David S. (1998). "Interacciones de la caseína: arroja luz sobre las cajas negras, la estructura en los productos lácteos". Revista Internacional de lácteos 8 (3): 171-7. doi:10.1016/S0958-6946 (98) 00040-5.
- Casco, M.E. (1947). "Estudios sobre proteínas de la leche. II. colorimétrico determinación de la hidrólisis parcial de las proteínas de la leche". Revista de Ciencias de la leche 30 (11): 881 – 4. doi:10.3168/jds. S0022-0302 (47) 92412-0.
- Kobayashi, Hideyuki (2004). "Polyporopepsin". En Barrett, Alan J.; Woessner, J. Fred; Rawlings, Neil D. Manual de las enzimas proteolíticas. PP. 111-5. doi:10.1016/B978-0-12-079611-3.50035-5. ISBN978-0-12-079611-3.
- Kumosinski, T.F.; Brown, E.M.; Farrell, S.M. (1993). "Modelado Molecular tridimensional de caseína bovina: un refinado, estructura reduce al mínimo energía κ-caseína". Revista de Ciencias de la leche 76 (9): 2507 – 20. doi:10.3168/jds. S0022-0302 (93) 4 77586. PMID8227653.
- Lucena, J.A. (2002). Formación y propiedades físicas de los geles de proteína de leche. Revista de Ciencias de la leche 85 (2): 281-94. doi:10.3168/jds. S0022-0302 (02) 74078-2. PMID11913691.
- Lucena, J.A.; Johnson, M.E.; Horne, D.S. (2003). "Invitó a revisión: perspectivas sobre la base de la reología y propiedades de textura de queso". Revista de Ciencias de la leche 86 (9): 2725 – 43. doi:10.3168/jds. S0022-0302 (03) 73869-7. PMID14507008.
- Poza, m..; Sieiro, C.; Carreira, L.; Barros-Velázquez, J.; Villa, G. T. (2003). "Producción y caracterización de la proteasa de la coagulación de la leche de Myxococcus xanthus tensión 422". Diario de la Microbiología Industrial y biotecnología 30 (12): 691 – 8. doi:10.1007/s10295-003-0100-y. PMID14634834.
- Rao, B. Mala; Tanksale, Aparna M.; Ghatge, Mohini S.; Deshpande, Vasanti V. (1998). "Aspectos moleculares y biotecnológicos de proteasas microbianas". Microbiología y Biología Molecular comentarios 62 (3): 597 – 635. PMC98927. PMID9729602.
- Silva, S.V.; Malcata, F.X. (2005). "Parcial identificación de péptidos solubles en agua liberada en las primeras etapas de la proteólisis en esterilizado sistemas queso ovinos: influencia del tipo de coagulante y arranque". Revista de Ciencias de la leche 88 (6): 1947-54. doi:10.3168/jds. S0022-0302 (05) 72870-8. PMID15905424.
- Twining, Sally S. (1984). "Ensayo de caseína marcado con isotiocianato de fluoresceína para enzimas proteolíticas". Bioquímica analítica 143 (1): 30 – 4. doi:10.1016/0003-2697 (84) 90553-0. PMID6442109.
- Vasbinder, A.J.; Rollema, H.S.; Bot, A.; de Kruif, C.G. (2003). "Gelificación mecanismo de leche como influenciados por la temperatura y el pH; Estudiado por el uso de transglutaminasa reticulado caseína micelas". Revista de Ciencias de la leche 86 (5): 1556 – 63. doi:10.3168/jds. S0022-0302 (03) 2 73741. PMID12778566.
- Walstra, Pieter (1979). "La voluminosidad de micelas de caseína bovina y algunas de sus implicaciones". Revista de investigación lechera 46 (2): 317-23. doi:10.1017/S0022029900017234. PMID469060.
Enlaces externos
- InterPro: IPR000117 Caseína kappa
- Fluoresceína Thiocarbamoyl-Kappa-caseína ensayo para los ensayos específicos de proteasas de la coagulación de la leche
- Biotecnología y Microbiología