Transferencia de energía de resonancia Förster

Transferencia de energía de resonancia Förster (TRASTE), transferencia de energía de resonancia de la fluorescencia (TRASTE), transferencia de energía de resonancia (RET) o transferencia de energía electrónica (EET) es un mecanismo que describe la transferencia de energía entre dos moléculas sensibles a la luz (cromóforos).[1] Un cromóforo donantes, inicialmente en su estado electrónico excitado, puede transferir energía a un cromóforo aceptor a través de nonradiative acoplamiento de dipolo – dipolo.[2] La eficacia de esta transferencia de energía es inversamente proporcional a la sexta potencia de la distancia entre el donador y aceptor, haciendo traste extremadamente sensibles a pequeños cambios en la distancia.[3]
Mediciones de eficiencia de trastes se pueden utilizar para determinar si dos fluoróforos están a cierta distancia uno del otro.[4] Estas mediciones se utilizan como una herramienta de investigación en campos como la biología y la química.
TRASTE es análoga a cerca de campo comunicación, en que el radio de la interacción es mucho menor que la longitud de onda de la luz emitida. En la región de campo cercano, el cromóforo excitado emite un fotón virtual al instante es absorbida por un cromóforo receptora. Estos fotones virtuales no son detectables, ya que su existencia viola la conservación de la energía y el ímpetu, y por lo tanto traste es conocido como un radiationless mecanismo. Electrodynamical de Quantum cálculos se han utilizado para determinar que radiationless (traste) y transferencia de energía radiativa son los corto - y largo alcance asíntotas de un único mecanismo unificado.[5][6]
Contenido
- 1 Terminología
- 2 Base teórica
- 3 Confirmación experimental de la teoría de transferencia de Förster Resonancia energética
- 4 Métodos para medir la eficiencia de traste
- 4.1 Emisión sensibilizado
- 4.2 Fotoblanqueo traste
- 4.3 Mediciones de toda la vida
- 5 Fluoróforos utilizado para trastes
- 5.1 Pares de CFP-YFP
- 5.2 BRET
- 5.3 Homo-FRET
- 6 Aplicaciones
- 6.1 Biología
- 7 Otros métodos de
- 8 Véase también
- 9 Referencias
- 10 Enlaces externos
Terminología
Transferencia de energía de resonancia Förster se nombra después del científico alemán Theodor Förster.[7] Cuando ambos cromóforos fluorescentes, el término "transferencia de energía de resonancia de la fluorescencia" es de uso frecuente en lugar de ello, aunque la energía no se transfiere realmente por fluorescencia.[8][9] Con el fin de evitar una interpretación errónea del fenómeno que es siempre una nonradiative transferencia de energía (incluso cuando ocurre entre dos cromóforos fluorescentes), el nombre de "Transferencia de energía de resonancia Förster" es preferido a "transferencia de energía de resonancia de fluorescencia;" sin embargo, este último goza de uso común en la literatura científica.[10] También debe señalarse que el traste no se limita a la fluorescencia. Puede ocurrir en relación con la fosforescencia también.[8]
Base teórica
La (traste) eficiencia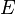 ) es la rendimiento cuántico de la transición de transferencia de energía, es decir la fracción de eventos de transferencia de energía ocurre por evento de excitación de donantes:[11]
) es la rendimiento cuántico de la transición de transferencia de energía, es decir la fracción de eventos de transferencia de energía ocurre por evento de excitación de donantes:[11]
donde  es la tasa de transferencia de energía,
es la tasa de transferencia de energía,  la tasa de decaimiento radiativo y el
la tasa de decaimiento radiativo y el  de son las constantes de velocidad de cualquier otras vías de la excitación.[12]
de son las constantes de velocidad de cualquier otras vías de la excitación.[12]
La eficacia de traste depende de muchos parámetros físicos que pueden agruparse como sigue:
- La distancia entre el donador y el aceptor (típicamente en el rango de 1-10 nm)
- El solapamiento espectral del donante espectro de emisión y el aceptor espectro de absorción.
- La orientación relativa de la emisión del donador momento de dipolo y la absorción del aceptor momento de dipolo.
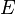 depende de la distancia de separación del donante al aceptor
depende de la distancia de separación del donante al aceptor  con una inversa 6 Ley de potencia debido al mecanismo de acoplamiento de dipolo-dipolo:
con una inversa 6 Ley de potencia debido al mecanismo de acoplamiento de dipolo-dipolo:
con  siendo la distancia de Förster de este par de donador y aceptor, es decir, la distancia a la que la transferencia de energía eficiencia es 50%.[12] La distancia de Förster depende de la superposición integral del espectro de emisión del donador con el espectro de absorción del aceptor y su mutua orientación molecular como expresada por la siguiente ecuación.[13][14]
siendo la distancia de Förster de este par de donador y aceptor, es decir, la distancia a la que la transferencia de energía eficiencia es 50%.[12] La distancia de Förster depende de la superposición integral del espectro de emisión del donador con el espectro de absorción del aceptor y su mutua orientación molecular como expresada por la siguiente ecuación.[13][14]
donde  es la fluorescencia rendimiento cuántico del donante en la ausencia de la aceptante, κ2 es el factor de orientación del dipolo,
es la fluorescencia rendimiento cuántico del donante en la ausencia de la aceptante, κ2 es el factor de orientación del dipolo,  es el Índice de refracción del medio,
es el Índice de refracción del medio,  es Número de Avogadro, y
es Número de Avogadro, y  se calcula la integral de solapamiento espectral como
se calcula la integral de solapamiento espectral como
donde 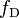 es el espectro de emisión del donador normalizado, y
es el espectro de emisión del donador normalizado, y  es el aceptor coeficiente de extinción molar.[15] El factor de orientación κ está dada por,
es el aceptor coeficiente de extinción molar.[15] El factor de orientación κ está dada por,
Donde  denota el momento de dipolo de transición normalizada de fluoróforo respectivo y
denota el momento de dipolo de transición normalizada de fluoróforo respectivo y 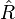 denota el desplazamiento inter-fluoróforo normalizado. κ2 = 2/3 se asume a menudo. Este valor se obtiene cuando ambos tintes giran libremente y pueden considerarse isotropically orientado durante la vida del estado excitado. Si bien el tinte es fijo o no es libre para girar, luego κ2 = 2/3 no es una suposición válida. En la mayoría de los casos, sin embargo, incluso modesta reorientación de los tintes resultados en bastante orientador promedio κ2 = 2/3 no da como resultado un error grande en la distancia de transferencia de energía Estimado debido a la dependencia de energía sexta de R0 en κ2. Incluso cuando κ2 es muy distinto de 2/3 el error puede estar asociado con un cambio en la R0 y así siguen siendo válidas las determinaciones de cambios en la distancia relativa para un sistema en particular. Proteínas fluorescentes no reorientar en un calendario que es más rápido que la vida de la fluorescencia. En este caso 0 ≤ κ2 ≤ 4.[15]
denota el desplazamiento inter-fluoróforo normalizado. κ2 = 2/3 se asume a menudo. Este valor se obtiene cuando ambos tintes giran libremente y pueden considerarse isotropically orientado durante la vida del estado excitado. Si bien el tinte es fijo o no es libre para girar, luego κ2 = 2/3 no es una suposición válida. En la mayoría de los casos, sin embargo, incluso modesta reorientación de los tintes resultados en bastante orientador promedio κ2 = 2/3 no da como resultado un error grande en la distancia de transferencia de energía Estimado debido a la dependencia de energía sexta de R0 en κ2. Incluso cuando κ2 es muy distinto de 2/3 el error puede estar asociado con un cambio en la R0 y así siguen siendo válidas las determinaciones de cambios en la distancia relativa para un sistema en particular. Proteínas fluorescentes no reorientar en un calendario que es más rápido que la vida de la fluorescencia. En este caso 0 ≤ κ2 ≤ 4.[15]
La eficacia de traste se relaciona con el rendimiento cuántico y la vida de la fluorescencia de la molécula donante como sigue:[16]
donde  y
y 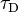 es el donante de vida de fluorescencia en presencia y en ausencia de un aceptor, respectivamente, o como
es el donante de vida de fluorescencia en presencia y en ausencia de un aceptor, respectivamente, o como
donde  y
y  es el donante de intensidades de fluorescencia con y sin un aceptor, respectivamente.
es el donante de intensidades de fluorescencia con y sin un aceptor, respectivamente.
Confirmación experimental de la teoría de transferencia de Förster Resonancia energética
La dependencia de la distancia inversa de sexto poder de transferencia de energía de resonancia Förster fue confirmada experimentalmente por Wilchek, Edelhoch y marca[17][18] uso de péptidos tryptophyl. Stryer, Haugland y Yguerabide[19] también demostró experimentalmente la dependencia teórica de transferencia de energía de resonancia Förster en la integral de superposición mediante un fundido indolosteroid como donante y una cetona como un aceptor. Sin embargo, se observó un montón de contradicciones de experimentos especiales con la teoría. La razón es que la teoría tiene carácter aproximado y da sobrestimadas distancias de 50-100 Angstrems (Vekshin N.L. transferencia de energía en macromoléculas, SPIE, 1997; Vekshin N.L. fotónica de biopolímeros, Springer, 2002).
Métodos para medir la eficiencia de traste
En fluorescencia microscopia, fluorescencia Microscopía de barrido láser confocal, así como en biología molecular, Traste es una herramienta útil para cuantificar la dinámica molecular en Biofísica y Bioquímica, tales como proteína-las interacciones entre proteínas, proteína,DNA interacciones y cambios conformacionales de la proteína. Para supervisar la formación de complejos entre dos moléculas, una de ellas está etiquetada con un donante y otro con un aceptor. La eficacia de traste es medida y utilizada para identificar las interacciones entre los complejos etiquetados. Hay varias maneras de medir la eficiencia de traste por monitorear los cambios en la fluorescencia emitida por el donante o el receptor.[20]
Emisión sensibilizado
Un método para medir la eficiencia de traste es medir la variación en la intensidad de emisión de aceptor.[14] Cuando el donador y aceptor en proximidad (1-10 nm) debido a la interacción de las dos moléculas, la emisión de aceptador aumentará debido al intermoleculares TRASTE de la donante para el aceptador. Para el control de cambios conformacionales de la proteína, la proteína Diana es etiquetada con un donador y un aceptor en dos loci. Cuando un giro o plegado de la proteína trae el cambio en la distancia o la orientación relativa del donador y aceptor, se observa cambio de traste. Si una interacción molecular o una proteína conformacional cambio depende ligand vinculante, esta técnica FRET es aplicable a indicadores fluorescentes para la detección del ligando.
Fotoblanqueo traste
Eficiencias de traste se pueden también deducir de la fotoblanqueo tarifas del donante en presencia y en ausencia de un aceptor.[14] Este método puede realizarse en la mayoría de los microscopios de fluorescencia; uno simplemente brilla la luz de excitación (de una frecuencia que se excite el donante pero no el aceptador significativamente) en muestras con y sin el fluoróforo aceptor y la fluorescencia del donante (por lo general separada de fluorescencia aceptador utilizando un filtro paso de banda) con el tiempo. El calendario es que de fotoblanqueo, segundos a minutos, con fluorescencia en cada curva está dada por

donde  es la constante de tiempo de decaimiento de fotoblanqueo y depende de si el receptor está presente o no. Fotoblanqueo consiste en la inactivación permanente de fluoróforos emocionado, impide la transferencia de energía de resonancia de un donante emocionado a un fluoróforo aceptor el fotoblanqueo de eso fluoróforo donador y así traste eficiencia conduce a una constante de tiempo más largo de fotoblanqueo decaimiento:
es la constante de tiempo de decaimiento de fotoblanqueo y depende de si el receptor está presente o no. Fotoblanqueo consiste en la inactivación permanente de fluoróforos emocionado, impide la transferencia de energía de resonancia de un donante emocionado a un fluoróforo aceptor el fotoblanqueo de eso fluoróforo donador y así traste eficiencia conduce a una constante de tiempo más largo de fotoblanqueo decaimiento:

donde  y
y  es el decaimiento de fotoblanqueo constantes de tiempo del donante en presencia y en ausencia de aceptador, respectivamente. (Nótese que la fracción es el recíproco de la utilizada para la medición de toda la vida).
es el decaimiento de fotoblanqueo constantes de tiempo del donante en presencia y en ausencia de aceptador, respectivamente. (Nótese que la fracción es el recíproco de la utilizada para la medición de toda la vida).
Esta técnica fue introducida por Jovin en 1989.[21] El uso de toda la curva de puntos para extraer las constantes de tiempo puede dar ventajas de exactitud sobre los otros métodos. Además, el hecho de que las mediciones de tiempo en segundos en lugar de nanosegundos, resulta más fácil que las mediciones de toda la vida de la fluorescencia, y porque las tasas de decaimiento de fotoblanqueo hacen no generalmente depende de las concentración de donantes (a menos que el aceptador de la saturación es un problema), no es necesario el control cuidadoso de las concentraciones necesarias para las mediciones de intensidad. Sin embargo, es importante mantener la iluminación lo mismo para las medidas de con - y sin-aceptador, photobleaching aumenta marcadamente con la luz incidente más intensa.
Mediciones de toda la vida
TRASTE eficiencia también puede ser determinado por el cambio en la fluorescencia toda la vida del donante.[14] Disminuirá la vida del donante en presencia del aceptador. Las mediciones de por vida de traste se utilizan en Microscopia de la fluorescencia de la vida.
Fluoróforos utilizado para trastes

Pares de CFP-YFP
Uno los fluoróforos de par común para uso biológico es un proteína fluorescente ciánica (CFP) – proteína fluorescente amarilla (YFP) par.[22] Ambas son variantes del color de proteína verde fluorescente (GFP). Etiquetado con colorantes fluorescentes orgánicos requiere purificación, modificación química y la inyección intracelular de una proteína huésped. Variantes de la GFP pueden acoplarse a una proteína del huésped por ingeniería genética que puede ser más conveniente. Además, una fusión de PPC y YFP vinculados por una proteasa secuencia de escote puede utilizarse como un ensayo de clivaje.[23]
BRET
Una limitación de traste es el requisito para la iluminación exterior iniciar a la transferencia de la fluorescencia, que puede conducir al ruido de fondo en los resultados de la excitación directa de la aceptante o a fotoblanqueo. Para evitar este inconveniente, Bioluminescence Transferencia de energía de resonancia (o BRET) se ha desarrollado.[24] Esta técnica utiliza un bioluminiscente luciferasa (típicamente la luciferasa de Lugares de Renilla) en lugar de PPC para producir una emisión del fotón inicial compatible con YFP.
Homo-FRET
En general, "Traste" se refiere a situaciones donde el donador y aceptor proteínas (o "fluoróforos") son de dos tipos diferentes. En muchas situaciones biológicas, sin embargo, los investigadores puede ser que necesite examinar las interacciones entre dos o más proteínas del mismo tipo, o de hecho la misma proteína con sí mismo, por ejemplo, si la proteína se pliega o forma parte de una cadena de polímeros de proteínas[25] o para otras cuestiones de cuantificación de células biológicas.[26]
Obviamente, las diferencias espectrales no será la herramienta utilizada para detectar y medir el traste, como el aceptador y proteína del donante emiten luz con las mismas longitudes de onda. Pero los investigadores pueden detectar diferencias en la polarización entre la luz que excita los fluoróforos y la luz que se emite, en una técnica llamada anisotropía FRET imagen; el nivel de cuantificado anisotropía (diferencia de polarización entre las vigas de excitación y emisión) entonces se convierte en una guía indicativa para cuántos trastes eventos han ocurrido.[27]
Aplicaciones
Biología
TRASTE se ha utilizado para medir la distancia y detectar interacciones moleculares en un número de sistemas y aplicaciones en biología y química.[28] TRASTE se puede utilizar para medir distancias entre dominios en una sola proteína y por lo tanto, para proporcionar información sobre la conformación de proteínas.[29] TRASTES también pueden detectar la interacción entre proteínas.[30] Aplicado en vivo, traste se ha utilizado para detectar la ubicación y las interacciones de los genes y las estructuras celulares, incluyendo intergrins y proteínas de membrana.[31] TRASTE puede utilizarse para obtener información acerca de las vías metabólicas o señalización.[32] TRASTE se utiliza también para estudiar balsas lipídicas en membranas celulares.[33]
TRASTE y BRET también son las herramientas comunes en el estudio de cinética de la reacción bioquímica y motores moleculares.
Las aplicaciones de fluorescencia resonancia energética de transferencia (traste) han ampliado enormemente en los últimos 25 años, y la técnica se ha convertido en una técnica básica en muchos campos biológicos y biofísicos. TRASTE se puede utilizar como regla espectroscópica en diversas áreas como la elucidación estructural de moléculas biológicas y sus interacciones ensayos in vitro, in vivo de seguimiento en la investigación celular, análisis de ácidos nucleicos, transducción de señales, luz cosecha y nanomateriales metálicos etc.. Basado en el mecanismo de traste se han desarrollado una variedad de nuevos sensores químicos y biosensores.[34]
Otros métodos de
Es un mecanismo diferente, pero relacionado, Transferencia de electrones de Dexter.
Un método alternativo para detectar la proximidad de proteína – proteína es la complementación bimolecular de la fluorescencia (Centro) donde dos mitades de un YFP están unidas a una proteína. Cuando se reúnen estas dos mitades que forman un fluoróforo después de cerca de 60 s – 1 hr.[35]
Véase también
- Acoplamiento de Förster
- Transferencia de energía superficial
- Transferencia de electrones Dexter
- Transferencia de energía de fluorescencia de tiempo resuelto
Referencias
- ^ Cheng, Ping-Chin (2006). "La formación del contraste en microscopía óptica". En Pawley, James B. Manual de microscopia Confocal de la biológica (3ª Ed.). Nueva York, NY: Springer. págs. 162 – 206. doi:10.1007/978-0-387-45524-2_8. ISBN978-0-387-25921-5.
- ^ Helms, Volkhard (2008). "Transferencia de energía de resonancia de la fluorescencia". Principios de la biología celular computacional. Weinheim: Wiley-VCH. p. 202. ISBN978-3-527-31555-0.
- ^ Harris, Daniel C. (2010). "Aplicaciones de la espectrofotometría". Análisis químico cuantitativo (8ª Ed.). Nueva York: W. H. Freeman y Co. pp. 419-44. ISBN978-1-4292-1815-3.
- ^ Zheng, Jie (2006). "Fluorescencia cuantitativa basada en la espectroscopia de resonancia energía transferencia análisis". En Stockand, James D.; Shapiro, Mark S. Canales iónicos: Métodos y protocolos. Métodos en Biología Molecular, volumen 337. Totowa, NJ: Humana Press. págs. 65-77. doi:10.1385/1-59745-095-2:65. ISBN978-1-59745-095-9.
- ^ Andrews, David L. (1989). "Una teoría unificada de la transferencia radiativa radiationless energía molecular". Física química 135 (2): 195-201. Bibcode:1989CP... 135..195A. doi:10.1016/0301-0104 (89) 87019-3.
- ^ Andrews, David L; Bradshaw, David S (2004). "Virtuales fotones, campos del dipolo y la transferencia de energía: un enfoque electrodynamical de quantum". Diario europeo de la física 25 (6): 845. doi:10.1088/0143-0807/25/6/017.
- ^ Förster, Theodor (1948). "Zwischenmolekulare Energiewanderung und Fluoreszenz" [energía Intermolecular migración y fluorescencia]. Annalen der Physik (en alemán) 437:: 55 – 75. Bibcode:1948AnP... 437... 55F. doi:10.1002/andp.19484370105.
- ^ a b Valeur, Bernard; Berberan-Santos, Mario (2012). "Transferencia de energía de excitación". Fluorescencia molecular: Principios y aplicaciones, 2ª ed.. Weinheim: Wiley-VCH. págs. 213 – 261. doi:10.1002/9783527650002.CH8. ISBN9783527328376.
- ^ Tutorial de microscopia de traste de Olympus
- ^ Glosario de términos usados en fotoquímica (3ª Ed.). IUPAC. 2007. p. 340.
- ^ Moens, Pierre. "Transferencia de energía de resonancia de espectroscopia de fluorescencia". 14 de julio, 2012.
- ^ a b Schaufele, Fred; DeMarco, Ignacio; Día, Richard N. (2005). "Proyección de imagen en el microscopio de campo amplio del traste". En Periasamy, Ammasi; Día, Richard. La proyección de imagen molecular: Traste microscopia y espectroscopia. Oxford: Oxford University Press. págs. 72 – 94. doi:10.1016/B978-019517720-6.50013-4. ISBN978-0-19-517720-6.
- ^ Förster, TH. (1965). «Deslocalizada de excitación y de transferencia de excitación». En Sinanoglu, Oktay. Química cuántica moderna. Conferencias de Istanbul. Parte III: Acción de cristales orgánicos y luz 3. Nueva York y Londres: Prensa académica. págs. 93-137. 2011-06-22.
- ^ a b c d Clegg, Roberto (2009). "Transferencia de energía de Förster Resonancia — FRET: ¿Qué es, por qué hacerlo y cómo hacerlo". En Gadella, Teodoro W. J. TRASTE y FLIM técnicas. Técnicas de laboratorio en Bioquímica y Biología Molecular, volumen 33. Elsevier. págs. 1 – 57. doi:10.1016/S0075-7535 (08) 00001-6. ISBN978-0-08-054958-3.
- ^ a b Demchenko, Alexander P. (2008). "Técnicas de detección de fluorescencia". Introducción a la detección de fluorescencia. Dordrecht: Springer. págs. 65-118. doi:10.1007/978-1-4020-9003-5_3. ISBN978-1-4020-9002-8.
- ^ Majoul, Irina; Jia, Yiwei; Duden, Rainer (2006). "Transferencia de energía de resonancia de fluorescencia práctico o Nanobioscopy Molecular de las células vivas". En Pawley, James B. Manual de microscopia Confocal de la biológica (3ª Ed.). Nueva York, NY: Springer. PP. 788-808. doi:10.1007/978-0-387-45524-2_45. ISBN978-0-387-25921-5.
- ^ Plantilla: ISRAEL diario de la química. Vol. 1. Jajaja SA. de 1963
- ^ {Marca Edelhoch, H., L., Wilchek, M. (1967). "Estudios de fluorescencia con péptidos de tryptophyl". Bioquímica 6 (2): 547-559. doi:10.1021 / bi00854a024. PMID 6047638}
- ^ Lakowicz, José R., ed. (1991). Principios. New York: Plenum Press. p. 172. ISBN978-0-306-43875-2.
- ^ "Protocolo de transferencia de energía de resonancia de la fluorescencia". Wellcome Trust. 24 de junio 2012.[link muerto]
- ^ Szöllősi, János; Alexander, Denis R. (2007). "Transferencia de la aplicación de energía de resonancia de la fluorescencia a la investigación de fosfatasas". En Klumpp, Susanne; Krieglstein, José. Proteína fosfatasas. Métodos en enzimología, volumen 366. Amsterdam: Elsevier. PP. 203 – 24. doi:10.1016/S0076-6879 (03) 66017-9. ISBN978-0-12-182269-9.
- ^ Periasamy, Ammasi (julio de 2001). "Microscopía de transferencia de energía de resonancia de fluorescencia: una mini revisión". Revista de óptica biomédica 6 (3): 287-291. Bibcode:2001JBO... 6..287 P. doi:10.1117/1.1383063. PMID11516318.
- ^ Nguyen, AW; Daugherty, PS (marzo de 2005). "Evolutiva optimización de proteínas fluorescentes para traste intracelular.". Biotecnología de la naturaleza 23 (3): 355-60. doi:10.1038/nbt1066. PMID15696158.
- ^ Bevan, Nicola; Rees, Stephen (2006). «Aplicaciones farmacéuticas de GFP y RCFP». En Chalfie, Martin; Kain, Steven R. Proteína verde fluorescente: Propiedades, aplicaciones y protocolos. Métodos de análisis bioquímico, volumen 47 (2 º Ed.). Hoboken, NJ: John Wiley & Sons. págs. 361-90. doi:10.1002/0471739499.CH16. ISBN978-0-471-73682-0.
- ^ Gautier, I.; Tramier, M.; Durieux, C.; Coppey, J.; Pansu, R.B.; Nicolas, J.-C.; Kemnitz, K.; Coppey-Moisan, M. (2001). "Homo-FRET microscopía en células vivas a medida la transición de monómero dímero de proteínas GFP-marcados con etiqueta". Diario biofísico 80 (6): 3000 – 8. Bibcode:2001BpJ... 80,3000 G. doi:10.1016/S0006-3495 (01) 76265-0. PMC1301483. PMID11371472.
- ^ Bader, Arjen N.; Hofman, Erik G.; Voortman, Jarno; Furgoneta Bergen En Henao, Paul M.P.; Gerritsen, Hans C. (2009). "Proyección de imagen de homo-FRET permite cuantificación de proteína tamaños de clúster con resolución subcelular". Diario biofísico 97 (9): 2613 – 22. Bibcode:2009BpJ... 97.2613B. doi:10.1016/j.BPJ.2009.07.059. PMC2770629. PMID19883605.
- ^ Gradinaru, Claudiu C.; Marushchak, Denys O.; Samim, Masood; Krull, Ulrich J. (2010). "Anisotropía de fluorescencia: de las moléculas individuales de vivir las células". El analista de 135 (3): 452-9. Bibcode:2010Ana... 135..452G. doi:10.1039/b920242k. PMID20174695.
- ^ Lakowicz, José R. (1999). Principios de la espectroscopia de fluorescencia (2ª ed.). Nueva York, NY: Kluwer Acad./Plenum publ pp. 374 – 443. ISBN978-0-306-46093-7.
- ^ Truong, Kevin; Ikura, Mitsuhiko (2001). "El uso de FRET imagen microscopía para detectar las interacciones proteína – proteína y cambios conformacionales de la proteína in vivo". Opinión actual en biología estructural 11 (5): 573 – 8. doi:10.1016/S0959-440 X (00) 00249-9. PMID11785758.
- ^ Pollok, B; Heim, R (1999). "Uso de GFP en aplicaciones basadas en el traste". Tendencias en biología de la célula 9 (2): 57 – 60. doi:10.1016/S0962-8924 (98) 01434-2. PMID10087619.
- ^ Sekar, R. B.; Periasamy, (2003). "Fluorescencia energía transferencia (traste) microscopia resonancia de localizaciones de proteína de la célula viva". El diario de la biología celular 160 (5): 629 – 33. doi:10.1083/JCB.200210140. PMC2173363. PMID12615908.
- ^ Ni, Qiang; Zhang, Jin (2010). "Visualización dinámica de señalización celular". En Endo, Isao; Nagamune, Teruyuki. Nano/Micro biotecnología. Avances en Ingeniería Bioquímica y la biotecnología, volumen 119. Springer. págs. 79-97. Bibcode:2010nmb... libro... 49m. doi:10.1007/10_2008_48. ISBN978-3-642-14946-7. PMID19499207.
- ^ Silvius, John R.; Nabi, Ivan Roberto (2006). "Energía de resonancia y amortiguamiento de la fluorescencia transferencia estudios de microdominios lipídicos en modelo y en las membranas biológicas (revisión)". Biología molecular de la membrana 23 (1): 5 – 16. doi:10.1080/09687860500473002. PMID16611577.
- ^ S. A., Hussain et al., (2015). "Sensor de transferencia de energía de resonancia (FRET) fluorescencia" (PDF). J. Spectrosc. Dyn. 5 (7): 1 – 16.
- ^ Hu, Chang-Deng; Chinenov, Yurii; Kerppola, Tom K. (2002). "Visualización de las interacciones entre bZIP y Rel familia proteínas en vivir las células usando Bimolecular de la fluorescencia complementación". Molecular Cell 9 (4): 789 – 98. doi:10.1016/S1097-2765 (02) 00496-3. PMID11983170.
Enlaces externos
- Efecto de traste en una película delgada en YouTube